
 Ag+(aq)+Cl-(aq),银离子与氨水结合,降低了溶液中银离子的浓度,使上述平衡正向移动,促使AgCl溶解.
Ag+(aq)+Cl-(aq),银离子与氨水结合,降低了溶液中银离子的浓度,使上述平衡正向移动,促使AgCl溶解.分析 Ⅰ.将等体积等浓度的AgNO3溶液和NaCl 溶液混合得到浊液W,过滤,得到滤液X 和白色沉淀Y,反应生成的沉淀Y为AgCl,滤液X中主要是硝酸钠;
Ⅱ.向滤液X 中滴加几滴饱和Na2S 溶液出现浑浊,说明滤液中含有银离子,说明银离子在加入氯化钠后不能完全沉淀;
Ⅲ.取少量白色沉淀Y,滴加几滴饱和Na2S 溶液沉淀变为黑色,生成沉淀为Ag2S,说明Ag2S溶度积较小,更难溶;
Ⅳ.取少量白色沉淀Y,滴加几滴浓氨水沉淀逐渐溶解,说明氯化银与氨水发生络合反应,可生成银氨络离子,以此解答该题.
解答 解:(1)将等体积等浓度的AgNO3溶液和NaCl溶液混合,反应生成AgCl白色沉淀,存在的沉淀溶解平衡为AgCl(g)?Ag+(aq)+Cl-(aq);
故答案为:AgCl(g)?Ag+(aq)+Cl-(aq);
(2)由步骤Ⅱ出现浑浊,说明Ag2S比AgCl溶解度更小,平衡向生成溶解度更小的方向移动,故答案为:Ag2S;
(3)该温度下,Ag2S比AgCl溶解度更小,氯化银转化成硫化银的反应为:2AgCl(s)+S2-(aq)?Ag2S(s)+2Cl-(aq),
故答案为:2AgCl(s)+S2-(aq)?Ag2S(s)+2Cl-(aq);
(4)在白色沉淀AgCl中,存在平衡:AgCl(g)  Ag+(aq)+Cl-(aq),银离子与氨水结合,降低了溶液中银离子的浓度,使上述平衡正向移动,促使AgCl溶解,
Ag+(aq)+Cl-(aq),银离子与氨水结合,降低了溶液中银离子的浓度,使上述平衡正向移动,促使AgCl溶解,
故答案为:AgCl(g)  Ag+(aq)+Cl-(aq),银离子与氨水结合,降低了溶液中银离子的浓度,使上述平衡正向移动,促使AgCl溶解;
Ag+(aq)+Cl-(aq),银离子与氨水结合,降低了溶液中银离子的浓度,使上述平衡正向移动,促使AgCl溶解;
(5)A.在步骤Ⅳ之后,继续滴加浓硝酸后,硝酸与氨水中和,生成Ag+,平衡左移,又有AgCl沉淀生成,故A正确;
B.由步骤Ⅳ可以推测:氨水可以结合Ag+,不能与Ag反应,实验室可不用氨水洗涤银镜反应后的试管,故B错误;
C.若在白色沉淀AgCl中滴加NaOH溶液,不发生反应,沉淀不能溶解,故C错误;
故答案为:BC.
点评 本题考查了性质实验方案的设计,为高频考点,题目难度较大,涉及难溶物溶度积的计算、氧化还原反应的配平、性质实验方案评价等知识,根据实验现象得出正确结论为解答关键,试题侧重考查学生的分析、理解能力及化学实验能力.


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:解答题
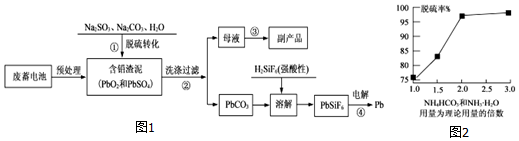
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过滤 | B. | 两种固体混合 | ||
| C. | 硫酸与氢氧化钠溶液的中和反应 | D. | 蒸发 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑤ | B. | ② | C. | ①③④⑤ | D. | ①②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 平衡时NH3的 物质的量mol |
| T1 | 1.2 |
| T2 | 1.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
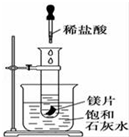 如图所示,把试管放入盛有25℃饱和澄清石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入10mL盐酸于试管中,试回答下列问题:
如图所示,把试管放入盛有25℃饱和澄清石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入10mL盐酸于试管中,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com