
| A. | ①②④⑤ | B. | ② | C. | ①③④⑤ | D. | ①②⑤ |
分析 ①从难溶电解质的溶解平衡的角度分析;
②氢氧化铝是难溶物质,存在沉淀溶解平衡和电离平衡;
③物质的溶解度不一定随温度的升高而增大;
④Mg(OH)2的溶解度比MgCO3小;
⑤为使离子完全沉淀,加入过量的沉淀剂,能使离子沉淀完全.
解答 解:①AgCl溶液中存在:AgCl(s) Ag+(aq)+Cl-(aq),Cl-浓度越大,则溶解的AgCl越少,故①正确;
Ag+(aq)+Cl-(aq),Cl-浓度越大,则溶解的AgCl越少,故①正确;
②氢氧化铝是难溶物质,存在沉淀溶解平衡和电离平衡,故②正确;
③物质的溶解度不一定随温度的升高而增大,如氢氧化钙溶液随温度的升高溶解度减小,故③错误;
④Mg(OH)2的溶解度比MgCO3小,故④正确;
⑤为使离子完全沉淀,加入过量的沉淀剂,能使离子沉淀完全,故⑤正确;
综上所述:①②④⑤正确;
故选A.
点评 本题考查较为综合,为高频考点,侧重考查学生的分析能力,题目涉及沉淀溶解平衡的计算应用,平衡移动的影响因素,难溶物质的溶解度比较方法,题目难度中等.


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 阳离子 | 阴离子 | ||
| OH- | SO42- | SO32- | |
| Ca2+ | ① | 微 | 不 |
| Fe3+ | 不 | 溶 | ② |
| Cu2+ | 不 | ③ | 不 |
| A. | ①处物质属于可溶性碱 | |
| B. | ②处物质组成为Fe2(SO3)3 | |
| C. | ③处物质为硫酸盐或者铜盐 | |
| D. | ①、③处物质在溶液中发生的反应一定是Cu2++2OH-═Cu(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Ag+(aq)+Cl-(aq),银离子与氨水结合,降低了溶液中银离子的浓度,使上述平衡正向移动,促使AgCl溶解.
Ag+(aq)+Cl-(aq),银离子与氨水结合,降低了溶液中银离子的浓度,使上述平衡正向移动,促使AgCl溶解.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
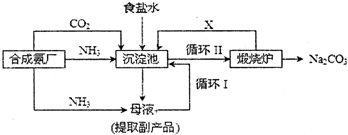
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
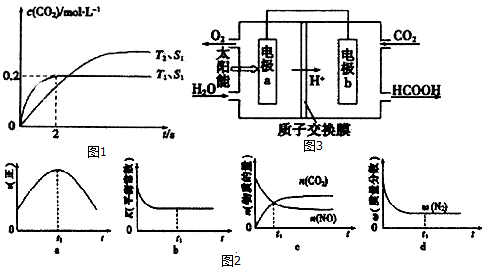
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入氦气使密闭容器中压强增大,平衡向正反应方向移动 | |
| B. | 增加X的物质的量,混合气体的密度减小 | |
| C. | X的正反应速率是Y的逆反应速率的$\frac{m}{n}$倍 | |
| D. | 降低温度,混合气体的平均相对分子质量增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用规格为10mL的量筒量取6.20mL的液体 | |
| B. | 称量氢氧化钠固体的质量时,将称量物放在滤纸上,并置于托盘天平的左盘,砝码放在托盘天平的右盘 | |
| C. | 利用蒸馏可除去液态混合物中沸点不同的易挥发、难挥发或不挥发的杂质 | |
| D. | 用四氯化碳萃取碘水中的碘,充分静置后紫红色液体在上层 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com