
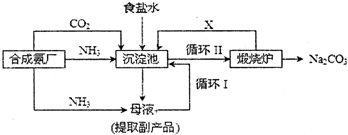
���� ��1���������з����Ļ�ѧ��ӦΪ����ʳ��ˮ��ͨ�백���Ͷ�����̼����̼�����ƾ��壻
��2��ѭ����������̼�����Ʒֽ����ɵĶ�����̼ͨ�������ѭ��ʹ�ã�
��3�������̹�ϵ��������Ӧ�������Ȼ��ƿ���ѭ�����ã����ԭ�������ʣ������ķ����ù��˷������У�
��4�����ݰ�������ˮ�����ɰ�ˮ����ˮ�����笠�������笠���Ũ���������Ȼ�淋�������������ͬʱͨ�백��ʹ��Һ������ǿ��ʹ̼������ת��Ϊ�ܽ�Ƚϴ��̼���ƣ���������Ȼ�淋Ĵ��ȣ�
��� �⣺��1���������з����Ļ�ѧ��ӦΪ����ʳ��ˮ��ͨ�백���Ͷ�����̼����̼�����ƾ��壬��Ӧ����ʽΪNH3+H2O+CO2+NaCl=NH4Cl+NaHCO3����
�ʴ�Ϊ��NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3����
��2��ѭ����������̼�����Ʒֽ����ɵĶ�����̼ͨ�������ѭ��ʹ�ã�����X���ʵĻ�ѧʽCO2���ʴ�Ϊ��CO2��
��3����Ϊ�Ȼ������ʣ����ĸҺ�У�����ѭ�����ǽ�δ��Ӧ���Ȼ��Ʒ��س������У��ӹ�Һ������з��������ķ���Ϊ���ˣ�
�ʴ�Ϊ��ѭ�����ˣ�
��4����������ˮ�����ɰ�ˮ����ˮ�����笠�������笠���Ũ���������Ȼ�淋�������������ѡ��a��ȷ��
ͨ�백��ʹ��Һ������ǿ��ʹ̼������ת��Ϊ�ܽ�Ƚϴ��̼���ƣ���������Ȼ�淋Ĵ�������ѡ��c��ȷ��ѡ��b����
�ʴ�Ϊ��ac��
���� ������һ�����Ѷȣ�����Կα��ϵ��Ƽ�ķ�Ӧԭ��������ʮ�������ͬʱҲ�����˻�ѧ����ʽ����д�ļ��ɡ�ʵ����̷������жϵ�������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����ӵĽṹʾ��ͼΪ | |
| B�� | ��������Ų���ͬ������ѧ����Ҳ��ͬ | |
| C�� | �ⵯ���õ���2H��3H��Ϊͬλ�� | |
| D�� | ͬ��Ԫ�ص�ԭ�Ӿ�����ͬ���������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ڢܢ� | B�� | �� | C�� | �٢ۢܢ� | D�� | �٢ڢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
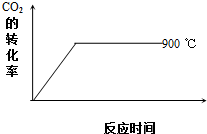 ̼���仯�����ڿƼ���������������������Ź㷺��Ӧ�ã��밴Ҫ��ش��������⣺
̼���仯�����ڿƼ���������������������Ź㷺��Ӧ�ã��밴Ҫ��ش��������⣺| �¶�/�� | 600 | 750 | 900 | 1100 | 1250 |
| ƽ�ⳣ��K | 2.5 | 1.6 | 1 | 0.9 | 0.6 |
| A | B | C | D | E | |
| n��CO2�� | 3 | 1 | 0 | 1 | 1 |
| n��H2�� | 2 | 1 | 0 | 1 | 2 |
| n��CO�� | 1 | 2 | 3 | 0.5 | 3 |
| n��H2O�� | 5 | 2 | 3 | 0.5 | 1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com