
【题目】根据编号①~⑩代表的元素在周期表中的位置,回答下列问题:
Ⅰ | Ⅱ | Ⅲ | Ⅳ | Ⅴ | Ⅵ | Ⅶ | 0 | |
1 | ① | ② | ||||||
2 | ③ | ④ | ⑤ | ⑥ | ||||
3 | ⑦ | ⑧ | ⑨ | ⑩ |
(1)能显+1价,还能显-1价的元素是____(填元素符号):②的分子式是____
(2)⑥与⑦按原子个数比1:1形成化合物甲,其电子式为____,向甲中滴加足量水时发生反应的化学方程式是____
(3)⑦、⑧、⑨三种元素最高价氧化物对应的水化物,碱性由强到弱的顺序排列为____(填化学式);⑩的最高价氧化物对应的水化物的化学式为____
(4)①、⑤、⑥三种元素形成的一种常见盐的化学式为____/span>,其中含有的化学键为____
(5)高温灼烧由⑦与⑩形成的化合物时,火焰呈____色。⑧可用于航空航天合金材料的制备,工业上冶炼该单质的化学方程式为____
(6)元素⑨的单质和⑦的最高价氧化物的水化物之间发生反应的离子方程式为____
【答案】H He ![]() 2Na2O2+2H2O=4NaOH+O2↑ NaOH>Mg(OH)2>Al(OH)3 HClO4 NH4NO3 离子键和共价键 黄 MgCl2
2Na2O2+2H2O=4NaOH+O2↑ NaOH>Mg(OH)2>Al(OH)3 HClO4 NH4NO3 离子键和共价键 黄 MgCl2![]() Mg+Cl2↑ 2Al+2OH-+2H2O=2
Mg+Cl2↑ 2Al+2OH-+2H2O=2![]() +3H2↑
+3H2↑
【解析】
根据各元素在元素周期表中的位置可知①~⑩元素分别为H、He、Li、C、N、O、Na、Mg、Al、Cl。
(1)能显+1价,还能显-1价的元素是H元素;②为氦,氦属于单原子分子,分子式是He;
(2)⑥与⑦按原子个数比1:1形成化合物为Na2O2,电子式为![]() ;过氧化钠与水反应生成氧气和氢氧化钠,化学方程式为2Na2O2+2H2O=4NaOH+O2↑;
;过氧化钠与水反应生成氧气和氢氧化钠,化学方程式为2Na2O2+2H2O=4NaOH+O2↑;
(3)金属性越强,最高价氧化物对应的水化物的碱性越强,同周期主族元素自左至右金属性减弱,所以金属性Na>Mg>Al,则碱性NaOH>Mg(OH)2>Al(OH)3;⑩为Cl元素,最高正价为+7价,最高价氧化物对应的水化物的化学式为HClO4;
(4)①、⑤、⑥分别为H、N、O,可以形成常见盐为NH4NO3,含有铵根和硝酸根之间的离子键、氮原子和氢原子以及氮原子和氧原子之间的共价键;
(5)⑦与⑩形成的化合物为NaCl,由于含有Na元素,所以火焰呈黄色;⑧为Mg元素,工业上电解熔融状态氯化镁制取镁单质,化学方程式为MgCl2![]() Mg+Cl2↑;
Mg+Cl2↑;
(6)元素⑨的单质Al,⑦的最高价氧化物的水化物为NaOH,二者反应生成偏铝酸钠和氢气,离子方程式为2Al+2OH-+2H2O=2![]() +3H2↑。
+3H2↑。


科目:高中化学 来源: 题型:
【题目】碳元素不仅能形成丰富多彩的有机化合物,而且还能形成多种无机化合物如C,同时自身可以形成多种单质如D和E,碳及其化合物的用途广泛。
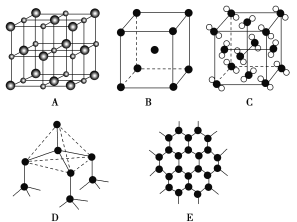
已知A为离子晶体,B为金属晶体,C为分子晶体
(1)图中分别代表了五种常见的晶体,分别是:A________,B________,C________,D________,E________。(填名称或化学式)
(2)干冰和冰是两种常见的分子晶体,关于两种晶体的比较中正确的是_____。
a.晶体的密度:干冰>冰 b.晶体的熔点:干冰>冰
c.晶体中的空间利用率:干冰>冰 d.晶体中分子间相互作用力类型相同
(3) 金刚石和石墨是碳的两种常见单质,下列叙述正确的有________。
a.金刚石中碳原子的杂化类型为sp3杂化,石墨中碳原子的杂化类型为sp2杂化
b.晶体中共价键的键长:金刚石中C—C<石墨中C—C
c.晶体的熔点:金刚石>石墨
d.晶体中共价键的键角:金刚石>石墨
e.金刚石晶体中只存在共价键,石墨晶体中则存在共价键、金属键和范德华力
f.金刚石和石墨的熔点都很高,所以金刚石和石墨都是原子晶体
(4)金刚石晶胞结构如图,一个晶胞中的C原子数目为 ________。
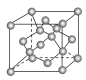
(5)C与孔雀石共热可以得到金属铜,金属铜采用面心立方最密堆积,已知Cu单质的晶体密度为ρ g/cm3,Cu的相对原子质量为M,阿伏加德罗常数为NA,则Cu的原子半径为 __________cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环丙叉环丙烷(b)由于其特殊的结构,一直受到化学家的重视,根据其转化关系(如图),下列说法正确的是
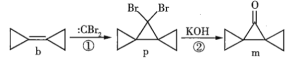
A.b的所有原子都在同一个平面内
B.b可以发生加成、氧化、加聚反应
C.p在氢氧化钠的醇溶液中加热生成烯烃
D.m的同分异构体中属于芳香化合物的共有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项比较中前者高于(或大于或强于)后者的是
A. CCl4和SiCl4的熔点
B. 对羟基苯甲醛(![]() )和邻羟基苯甲醛(
)和邻羟基苯甲醛(![]() )的沸点
)的沸点
C. I2在水中的溶解度和I2在CCl4溶液中的溶解度
D. H2SO3和H2SO4的酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物的结构简式为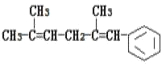 ,判断下列说法中不正确的是( )
,判断下列说法中不正确的是( )
A.它可以使酸性KMnO4溶液褪色
B.它可发生取代反应、加成反应、加聚反应、氧化反应
C.1mol该有机物完全燃烧消耗氧气为18.5mol
D.它与氢气发生加成反应,最多可以消耗5mol氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜是一种重要的化工产品,常用作有机合成催化剂,还可用于颜料、防腐等工业,它不溶于H2SO4、HNO3和醇,微溶于水,可溶于浓盐酸和氨水,在潮湿空气中易水解氧化成绿色的碱式氯化铜[Cu2(OH)4-nCln],随着环境酸度的改变n随之改变。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如下:
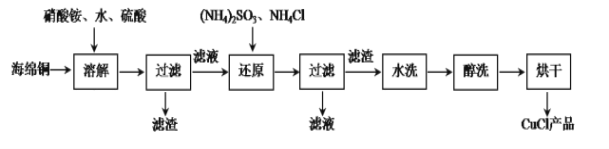
(1)过滤用到的玻璃仪器有烧杯、玻璃棒、________。
(2)还原过程中发生的主要反应的离子方程式:__________,若将(NH4)2SO3换成铁粉也可得到CuCl,写出离子方程式___________。
(3)析出的CuCl晶体水洗后要立即用无水乙醇洗涤,在真空干燥机内于70℃干燥2h,冷却密封包装。真空干燥、密封包装的原因是:______________________________。
(4)随着PH值减小[Cu2(OH)4-nCln]中Cu% ________。(填字母)
A. 增大 B.不变 C. 不能确定 D. 减小
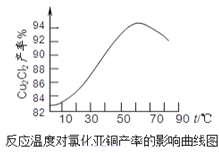
(5)如图是各反应物在最佳配比条件下,反应温度对CuCl产率影响。由图可知,溶液温度控制在60℃时,CuCl产率能达到94%,当温度高于65℃ 时,CuCl产率会下降,从生成物的角度分析,其原因可能是_____。
(6)以碳棒为电极电解CuCl2溶液也可得到CuCl,写出电解时阴极上发生的电极反应式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两种非金属元素:①甲元素形成的单质比乙元素形成的单质易与![]() 化合;②甲元素形成的单质能与乙元素形成的阴离子发生置换反应;③与某金属反应时,甲原子得电子数目比乙的多;④甲元素形成的单质的熔、沸点比乙元素形成的单质的低;⑤甲元素的简单氢化物水溶液的酸性比乙元素的简单氢化物水溶液的酸性强;⑥甲的氧化物的水化物的酸性强于乙的氧化物的水化物的酸性。其中能说明甲元素的非金属性比乙元素强的是( )
化合;②甲元素形成的单质能与乙元素形成的阴离子发生置换反应;③与某金属反应时,甲原子得电子数目比乙的多;④甲元素形成的单质的熔、沸点比乙元素形成的单质的低;⑤甲元素的简单氢化物水溶液的酸性比乙元素的简单氢化物水溶液的酸性强;⑥甲的氧化物的水化物的酸性强于乙的氧化物的水化物的酸性。其中能说明甲元素的非金属性比乙元素强的是( )
A.①②⑥B.①②④⑤C.①②D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增加,由这些元素组成的常见物质的转化关系如下图,其中a、b、d、g为化合物,a为淡黄色固体,c是Z的单质,该单质与沸水缓慢反应,且该单质可制造照明弹;f为固体单质。下列有关说法正确的是
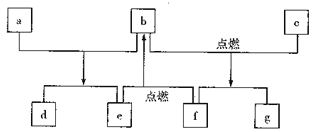
A. 简单离子的半径:Y>Z>X B. 元素的非金属性:W>X
C. 最高价氧化物对应水化物的碱性:Y>Z D. X、Y两种元素组成的化合物只含离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案或实验结论不正确的是( )
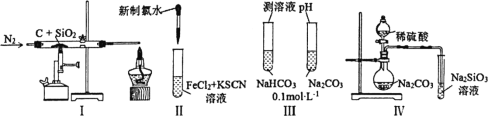
A.图Ⅰ结论,元素非金属性:C>Si
B.图Ⅱ结论,氧化性:Cl2>Fe3+
C.图Ⅲ结论,溶液pH:Na2CO3>NaHCO3
D.图Ⅳ结论,酸性:H2SO4>H2SiO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com