
【题目】环丙叉环丙烷(b)由于其特殊的结构,一直受到化学家的重视,根据其转化关系(如图),下列说法正确的是
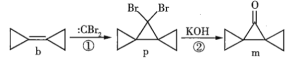
A.b的所有原子都在同一个平面内
B.b可以发生加成、氧化、加聚反应
C.p在氢氧化钠的醇溶液中加热生成烯烃
D.m的同分异构体中属于芳香化合物的共有5种
科目:高中化学 来源: 题型:
【题目】关于芳香族化合物A的有关信息如下:
①A中碳的质量分数为77.77%,H的质量分数为7.40%,其余为氧;
②光谱法测定时波谱图反映出A的相对分子质量为108;
③A可以与乙酸在浓硫酸加热条件下生成有水果香味的产物;
④A可以与金属钠反应放出氢气,但不能与氢氧化钠反应;试回答:
(1)测A的相对分子质量的光谱为____(填字母)。A苯环上的一溴代物有____种。
A.红外光谱 B.质谱 C.核磁共振谱
(2)A通常有三种不同类别的芳香族同分异构体,试写出另两种不同类别的同分异构体的结构简式(各写一种):____,____。
(3)写出③中反应的化学方程式:_____。
(4)A在铜丝催化作用下加热发生反应的化学方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生为探究锌与盐酸反应过程中的速率变化,在![]() 时,向100 mL 2 mol·L-1盐酸中加入过量的锌粉,测得氢气体积(已换算成标准状况)累计值如下:
时,向100 mL 2 mol·L-1盐酸中加入过量的锌粉,测得氢气体积(已换算成标准状况)累计值如下:
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
(1)①在2~3 min时间段内,用盐酸的浓度变化表示的反应速率为_______.
②在0~5min内,反应速率最大的时间段是___(填 “1~2 min”、“2~3 min”或“3~4 min”)。
(2)若完全反应后放出15.2 kJ的热量,则反应Zn(s) + 2HCl(aq)=ZnCl2(aq) + H2(g)的△H=____
(3)为了减缓反应速率但不减少产生气体的量,可向反应物中分别加入等体积的下列液体,你认为可行的是_______(填字母)。
a. 蒸馏水 b. Na2CO3溶液 c. NaNO3溶液
(4)为了加快反应速率但不减少产生气体的量,某同学向反应物中加入了少量CuSO4固体,该同学操作____(填 “合理”或“不合理”),理由是_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4既是一种重要的能源,也是一种重要的化工原料。
(1)甲烷高温分解生成氢气和碳。在密闭容器中进行此反应时,要通入适量空气使部分甲烷燃烧,其目的是____________。已知25℃、101 kPa时,1 mol甲烷完全燃烧生成CO2和液态水时放出896 kJ热量,则甲烷的热值为___kJ·g-1。
(2)一定温度下,在偏铝酸亚铜(CuAlO2)的催化作用下,CH4与CO2转化成乙酸,可实现“CO2减排”,写出反应的化学方程式__________,其优点是_____(请写出一条)。
(3)甲烷可以消除氮氧化物污染。如: CH4(g)+2NO2(g)![]() N2(g) + CO2(g) + 2H2O(g)。
N2(g) + CO2(g) + 2H2O(g)。
①下列措施能够加快化学反应速率的是______。
a. 使用催化剂 b. 降低温度 c. 及时分离水
②若上述反应在恒容密闭容器中进行,则下列叙述能说明该反应达平衡的是_____。
a. 混合气体的质量不再变化
b. c(NO2) = 2c(N2)
c. 单位时间内生成1 mol CO2,同时生成2 mol NO2
(4)甲烷可直接应用于燃料电池,该电池采用可传导O2-的固体氧化物为电解质,其工作原理如图所示:
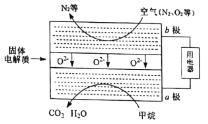
①b极电极反应式为_________。
②若燃料电池消耗的空气在标准状况下的体积是5.6L(假设空气中O2体积分数为20%),则理论上消耗甲烷____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究所对含硫酸亚铁和硫酸铜的工业废料进行相关的研究。实验过程如下:
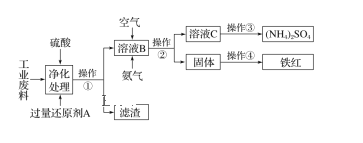
回答下列问题:
(1)滤渣的成分为______________,操作②的名称为____________。
(2)上图溶液B中所发生反应的离子方程式为_________________________________。
(3)实验要求先向溶液B中通入过量的空气,证明通入空气过量的方法是___________________
(4)操作③第一步需要的仪器除了酒精灯、铁架台外,还需要____________________________。
(5)某同学利用下面装置制备氢气并利用氢气还原某金属氧化物,根据要求回答问题。
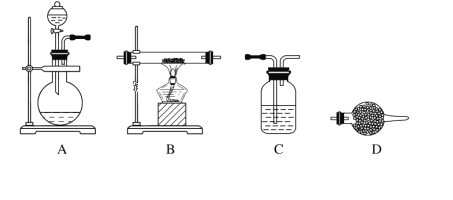
①请设计一个实验方案验证H2的还原性并检验其氧化产物,其装置连接顺序是A→________→________→________→D(除D装置外,其他装置不能重复使用),最后D装置中所加药品为________,其作用是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列文献记载所涉及的化学知识叙述错误的是
A. 明代《天工开物》之《燔石·青矾》卷中“取入缸中浸三个小时,漉入釜中煎炼”,运用了过滤的化学操作。
B. “┄欲去杂还纯,再入水煎炼┄倾入盆中,经宿结成白雪”采用了重结晶的方法。
C. “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应。
D. “水银乃至阴之毒物,因火煅丹砂而出,加以硫黄升而为银朱”该过程应用了升华的物理方法。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列叙述正确的是( )
A.1molFe溶于过量稀硝酸,电子转移数为2NA
B.标准状况下,2.24LCCl4含有分子的数目为0.1NA
C.46gNO2和N2O4混合气体中含有原子总数为3NA
D.1L0.1mol/L的NaHCO3溶液中,HCO3-、CO32-离子数之和为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据编号①~⑩代表的元素在周期表中的位置,回答下列问题:
Ⅰ | Ⅱ | Ⅲ | Ⅳ | Ⅴ | Ⅵ | Ⅶ | 0 | |
1 | ① | ② | ||||||
2 | ③ | ④ | ⑤ | ⑥ | ||||
3 | ⑦ | ⑧ | ⑨ | ⑩ |
(1)能显+1价,还能显-1价的元素是____(填元素符号):②的分子式是____
(2)⑥与⑦按原子个数比1:1形成化合物甲,其电子式为____,向甲中滴加足量水时发生反应的化学方程式是____
(3)⑦、⑧、⑨三种元素最高价氧化物对应的水化物,碱性由强到弱的顺序排列为____(填化学式);⑩的最高价氧化物对应的水化物的化学式为____
(4)①、⑤、⑥三种元素形成的一种常见盐的化学式为____/span>,其中含有的化学键为____
(5)高温灼烧由⑦与⑩形成的化合物时,火焰呈____色。⑧可用于航空航天合金材料的制备,工业上冶炼该单质的化学方程式为____
(6)元素⑨的单质和⑦的最高价氧化物的水化物之间发生反应的离子方程式为____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知锌及其化合物的性质与铝及其化合物相似。如图横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4 ]2-的物质的量浓度的对数。25℃时,下列说法中不正确的是

A. 往ZnCl2溶液中加入过量氢氧化钠溶液,反应的离子方程式为Zn2++4OH-=[Zn(OH)4]2-
B. 若要从某废液中完全沉淀Zn2+,通常可以调控该溶液的pH在8.0—12.0之间
C. pH=8.0与pH=12.0的两种废液中,Zn2+浓度之比为108
D. 该温度时,Zn(OH)2的溶度积常数(Ksp)为1×l0-10
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com