
【题目】某学生为探究锌与盐酸反应过程中的速率变化,在![]() 时,向100 mL 2 mol·L-1盐酸中加入过量的锌粉,测得氢气体积(已换算成标准状况)累计值如下:
时,向100 mL 2 mol·L-1盐酸中加入过量的锌粉,测得氢气体积(已换算成标准状况)累计值如下:
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
(1)①在2~3 min时间段内,用盐酸的浓度变化表示的反应速率为_______.
②在0~5min内,反应速率最大的时间段是___(填 “1~2 min”、“2~3 min”或“3~4 min”)。
(2)若完全反应后放出15.2 kJ的热量,则反应Zn(s) + 2HCl(aq)=ZnCl2(aq) + H2(g)的△H=____
(3)为了减缓反应速率但不减少产生气体的量,可向反应物中分别加入等体积的下列液体,你认为可行的是_______(填字母)。
a. 蒸馏水 b. Na2CO3溶液 c. NaNO3溶液
(4)为了加快反应速率但不减少产生气体的量,某同学向反应物中加入了少量CuSO4固体,该同学操作____(填 “合理”或“不合理”),理由是_______
【答案】0.1 mol·L-1·min-1 2~3min -152 kJ·mol-1 a 合理 锌和置换出的铜构成原电池,加快反应速率,且锌过量,不影响生产气体的量(答案合理即可)
【解析】
(1)①根据氢气的体积计算消耗HCl的物质的量,再根据速率公式进行计算;
②相同时间段内,生成气体越多,反应速率越快;
(2)根据热化学方程式的意义计算反应热;
(3)根据影响反应速率的因素以及物质的化学性质分析解答;
(4)根据原电池原理的应用分析解答。
(1)①在2~3 min时间段内,生成氢气物质的量为![]() ,根据关系式2HCl~H2,可知该时间段内消耗盐酸的物质的量为0.01mol,则在2~3 min时间段内,用盐酸的浓度变化表示的反应速率为
,根据关系式2HCl~H2,可知该时间段内消耗盐酸的物质的量为0.01mol,则在2~3 min时间段内,用盐酸的浓度变化表示的反应速率为![]() ;
;
②在1~2 min、2~3 min、3~4 min时间段中,产生气体的体积分别为70mL、112mL、68mL,相同时间段内,生成气体越多,反应速率越快,由此可知反应速率最大的时间段为2~3min;
(2)盐酸中HCl的物质的量为![]() ,由此可知,消耗0.2molHCl放出15.2 kJ的热量,则消耗2molHCl时,放出152 kJ的热量,故反应Zn(s) + 2HCl(aq)=ZnCl2(aq) + H2(g)的△H= -152 kJ·mol-1;
,由此可知,消耗0.2molHCl放出15.2 kJ的热量,则消耗2molHCl时,放出152 kJ的热量,故反应Zn(s) + 2HCl(aq)=ZnCl2(aq) + H2(g)的△H= -152 kJ·mol-1;
(3)a. 在盐酸中加入蒸馏水,氢离子浓度减小,反应速率减慢,但是氢离子物质的量不变,故不减少产生氢气的量,故a可行;
b. 在盐酸中加入Na2CO3溶液,Na2CO3与盐酸反应生成二氧化碳和水,减小了氢离子物质的量,故会减少氢气的量,故b不可行;
c. 在盐酸中加入NaNO3溶液,硝酸根在酸性环境下表现强氧化性,生成NO,而不生成氢气,故c不可行;
(4)为了加快反应速率但不减少产生气体的量,某同学向反应物中加入了少量CuSO4固体,因为锌和置换出的铜构成原电池,加快反应速率,且锌过量,不影响生产气体的量故该同学的操作合理。


科目:高中化学 来源: 题型:
【题目】在恒温、恒容的密闭容器中进行反应 A(g)═B(g)+C(g),若反应物的浓度由2molL-1 降到 0.8molL-1 需要 20s,那么反应物浓度再由 0.8molL-1 降到 0.2molL-1 所需要的时间为
A.10sB.大于 10sC.小于 10sD.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】著名的获得诺贝尔奖的狄尔斯![]() 阿德尔反应,是由共轭双烯与烯烃或炔烃反应生成六元环的反应。如:CH2=CH-CH=CH2+CH2=CH2
阿德尔反应,是由共轭双烯与烯烃或炔烃反应生成六元环的反应。如:CH2=CH-CH=CH2+CH2=CH2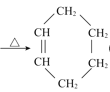
![]() 可表示为
可表示为![]()
![]() ,实际是个加成反应。工业上常用下列流程制取重要化学原料
,实际是个加成反应。工业上常用下列流程制取重要化学原料![]() (M)。
(M)。

流程中的A为天然橡胶的单体,分子式为C5H8。
(1)A的名称是___,B的结构简式是___。
(2)A的属于炔烃的同分异构体一共有___种,A与B反应生成的另一种含六元环的化合物的结构简式为___。
(3)②反应的类型为___,③反应的化学方程式为:___。
(4)按下列要求写出B的两种同分异构体的结构简式:___。
(Ⅰ)能发生银镜反应;(Ⅱ)分子结构中含有两个甲基;(Ⅲ)能发生水解反应
由丙烯制得B经如下流程:CH3-CH=CH2![]() CH3CHClCH2Cl
CH3CHClCH2Cl![]() C→X→Y→Z→CH2=CH-COOH
C→X→Y→Z→CH2=CH-COOH![]() B
B
(5)参照流程中的前两步和最后一步的书写方法写出其他中间步骤的流程:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳元素不仅能形成丰富多彩的有机化合物,而且还能形成多种无机化合物如C,同时自身可以形成多种单质如D和E,碳及其化合物的用途广泛。
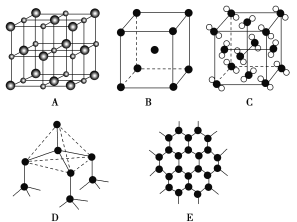
已知A为离子晶体,B为金属晶体,C为分子晶体
(1)图中分别代表了五种常见的晶体,分别是:A________,B________,C________,D________,E________。(填名称或化学式)
(2)干冰和冰是两种常见的分子晶体,关于两种晶体的比较中正确的是_____。
a.晶体的密度:干冰>冰 b.晶体的熔点:干冰>冰
c.晶体中的空间利用率:干冰>冰 d.晶体中分子间相互作用力类型相同
(3) 金刚石和石墨是碳的两种常见单质,下列叙述正确的有________。
a.金刚石中碳原子的杂化类型为sp3杂化,石墨中碳原子的杂化类型为sp2杂化
b.晶体中共价键的键长:金刚石中C—C<石墨中C—C
c.晶体的熔点:金刚石>石墨
d.晶体中共价键的键角:金刚石>石墨
e.金刚石晶体中只存在共价键,石墨晶体中则存在共价键、金属键和范德华力
f.金刚石和石墨的熔点都很高,所以金刚石和石墨都是原子晶体
(4)金刚石晶胞结构如图,一个晶胞中的C原子数目为 ________。
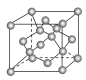
(5)C与孔雀石共热可以得到金属铜,金属铜采用面心立方最密堆积,已知Cu单质的晶体密度为ρ g/cm3,Cu的相对原子质量为M,阿伏加德罗常数为NA,则Cu的原子半径为 __________cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气中氮氧化物和碳氢化合物受紫外线作用可产生一次污染物——光化学烟雾,其中部分物质的反应过程如图所示。下列说法正确的是( )

A.该过程中![]() 作催化剂B.反应过程中没有电子转移
作催化剂B.反应过程中没有电子转移
C.反应过程中氮氧化物不断被消耗D.丙烯转化为甲醛和乙醛
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铝粉与Fe3O4粉末配制成铝热剂,分成三等份。
①一份直接放入足量的烧碱溶液中,充分反应后放出气体在标准状况下的体积为V1;
②一份在高温下恰好反应完全,反应后的混合物与足量的盐酸反应后,放出的气体在标准状况下的体积为V2;
③一份直接放入足量的盐酸中,充分反应后放出气体在标准状况下的体积为V3。
下列说法正确的是( )
A. V1=V3>V2 B. V2>V1=V3 C. V1=V2>V3 D. V1>V3>V2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mLNaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入0.2mol·L-1的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。
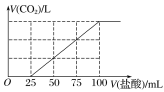
下列判断正确的是( )
A.所得溶液的溶质成分为NaOH和Na2CO3
B.所得溶液的溶质成分为NaHCO3和Na2CO3
C.原NaOH溶液的浓度为0.1mol·L-1
D.通入CO2在标准状况下的体积为448mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环丙叉环丙烷(b)由于其特殊的结构,一直受到化学家的重视,根据其转化关系(如图),下列说法正确的是
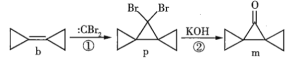
A.b的所有原子都在同一个平面内
B.b可以发生加成、氧化、加聚反应
C.p在氢氧化钠的醇溶液中加热生成烯烃
D.m的同分异构体中属于芳香化合物的共有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两种非金属元素:①甲元素形成的单质比乙元素形成的单质易与![]() 化合;②甲元素形成的单质能与乙元素形成的阴离子发生置换反应;③与某金属反应时,甲原子得电子数目比乙的多;④甲元素形成的单质的熔、沸点比乙元素形成的单质的低;⑤甲元素的简单氢化物水溶液的酸性比乙元素的简单氢化物水溶液的酸性强;⑥甲的氧化物的水化物的酸性强于乙的氧化物的水化物的酸性。其中能说明甲元素的非金属性比乙元素强的是( )
化合;②甲元素形成的单质能与乙元素形成的阴离子发生置换反应;③与某金属反应时,甲原子得电子数目比乙的多;④甲元素形成的单质的熔、沸点比乙元素形成的单质的低;⑤甲元素的简单氢化物水溶液的酸性比乙元素的简单氢化物水溶液的酸性强;⑥甲的氧化物的水化物的酸性强于乙的氧化物的水化物的酸性。其中能说明甲元素的非金属性比乙元素强的是( )
A.①②⑥B.①②④⑤C.①②D.④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com