
【题目】某研究所对含硫酸亚铁和硫酸铜的工业废料进行相关的研究。实验过程如下:
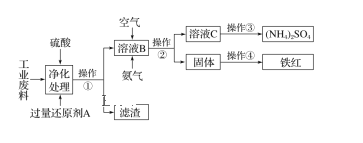
回答下列问题:
(1)滤渣的成分为______________,操作②的名称为____________。
(2)上图溶液B中所发生反应的离子方程式为_________________________________。
(3)实验要求先向溶液B中通入过量的空气,证明通入空气过量的方法是___________________
(4)操作③第一步需要的仪器除了酒精灯、铁架台外,还需要____________________________。
(5)某同学利用下面装置制备氢气并利用氢气还原某金属氧化物,根据要求回答问题。
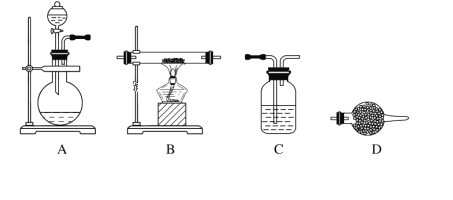
①请设计一个实验方案验证H2的还原性并检验其氧化产物,其装置连接顺序是A→________→________→________→D(除D装置外,其他装置不能重复使用),最后D装置中所加药品为________,其作用是_______________________________。
【答案】Fe、Cu 过滤 4Fe2++O2+8NH3+10H2O===8NH4++4Fe(OH)3↓ 取上层清液少许于试管中,加入酸性高锰酸钾溶液,酸性高锰酸钾溶液的紫色不变 蒸发皿、玻璃棒 C B D 碱石灰 防止空气中的水蒸气进入前面装置中
【解析】
含硫酸亚铁和硫酸铜的工业废料,结合流程可知,过量还原性试剂A为Fe,置换出Cu,则操作①为过滤,滤渣中为Cu和过量的Fe;溶液B中主要含硫酸亚铁,通入空气和氨气,反应生成硫酸铵和氢氧化铁,操作②为过滤,固体为氢氧化铁,操作④为加热,生成红色的氧化铁;溶液C为硫酸铵溶液,则操作③为蒸发结晶得到硫酸铵晶体,然后结合氢气还原金属氧化物时,先通入氢气后加热,试管冷却后再停止通入氢气来解答。
含硫酸亚铁和硫酸铜的工业废料,结合流程可知,过量还原性试剂A为Fe,置换出Cu,则操作①为过滤,滤渣中为Cu和过量的Fe;溶液B中主要含硫酸亚铁,通入空气和氨气,反应生成硫酸铵和氢氧化铁,操作②为过滤,固体为氢氧化铁,操作④为加热,生成红色的氧化铁;溶液C为硫酸铵溶液,则操作③为蒸发结晶得到硫酸铵晶体。
(1)由上述分析可知,滤渣为Fe、Cu,操作①为过滤,故答案为Fe、Cu;过滤;
(2)B中所发生反应的离子方程式为4Fe2++O2+8NH3+10H2O=8NH4++4Fe(OH)3↓,故答案为4Fe2++O2+8NH3+10H2O=8NH4++4Fe(OH)3↓;
(3)向溶液B中通入过量的空气,证明通入空气过量,即亚铁离子不存在,其方法是取上层清液少许于试管中,加入酸性高锰酸钾溶液,酸性高锰酸钾溶液的紫色不变(无变化),故答案为取上层清液少许于试管中,加入酸性高锰酸钾溶液,酸性高锰酸钾溶液的紫色不变;
(4)操作③为蒸发结晶,还需要的仪器为蒸发皿、玻璃棒,故答案为蒸发皿,玻璃棒;
(5)根据验证H2的还原性并检验其氧化产物,装置顺序依次为制取氢气装置A、干燥氢气装置C、还原金属氧化物B、检验还原产物D、吸收空气中的水分装置D,连接顺序为:A-C-B-D-D,D装置中所加药品碱石灰,其作用为防止空气中水蒸气进入前面装置中,故答案为C,B,D,碱石灰,防止空气中水蒸气进入前面装置中。


科目:高中化学 来源: 题型:
【题目】一定条件下,向某容积可变的密闭容器中充入1 mol N2和3 mol H2发生反应: N2+3H2![]() 2NH3。下列说法不正确的是
2NH3。下列说法不正确的是
A.升高温度能加快化学反应速率
B.增大体积能减慢化学反应速率
C.充分反应后生成NH3的物质的量小于2 mol
D.达到化学平衡状态时,v(H2)正=v(NH3)逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气中氮氧化物和碳氢化合物受紫外线作用可产生一次污染物——光化学烟雾,其中部分物质的反应过程如图所示。下列说法正确的是( )

A.该过程中![]() 作催化剂B.反应过程中没有电子转移
作催化剂B.反应过程中没有电子转移
C.反应过程中氮氧化物不断被消耗D.丙烯转化为甲醛和乙醛
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mLNaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入0.2mol·L-1的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。
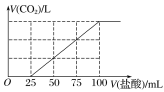
下列判断正确的是( )
A.所得溶液的溶质成分为NaOH和Na2CO3
B.所得溶液的溶质成分为NaHCO3和Na2CO3
C.原NaOH溶液的浓度为0.1mol·L-1
D.通入CO2在标准状况下的体积为448mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中A~J分别代表相关反应中的一种物质,已知A分解得到等物质的量的B、C、D,已知B、D为常温下的气态化合物,C为常温下的液态化合物,F为黑色固体单质,I为红棕色气体。图中有部分生成物未标出。请填写以下空白: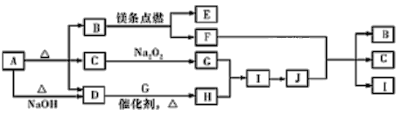
(1)A的化学式为___,C的电子式为___;
(2)写出下列反应的化学方程式:
D+G→H___;
F+J→B+C+I____;
(3)2molNa2O2与足量C反应转移电子的物质的量为___mol;
(4)I与足量C生成J的过程中氧化剂与还原剂的物质的量之比为___;
(5)容积为10mL的试管中充满I和G的混合气体,倒立于盛水的水槽中,水全部充满试管,则原混合气体中 I与G的体积之比为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环丙叉环丙烷(b)由于其特殊的结构,一直受到化学家的重视,根据其转化关系(如图),下列说法正确的是
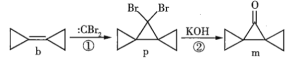
A.b的所有原子都在同一个平面内
B.b可以发生加成、氧化、加聚反应
C.p在氢氧化钠的醇溶液中加热生成烯烃
D.m的同分异构体中属于芳香化合物的共有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由塑化剂引起的食品、药品问题受到广泛关注。下列关于塑化剂DBP(结构如下图)的说法不正确的是
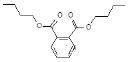
A.属于芳香族化合物,能溶于水
B.其核磁共振氢谱共有6种吸收峰
C.分子中一定有12个原子位于同一平面上
D.水解得到的酸性产物能与乙二醇发生缩聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物的结构简式为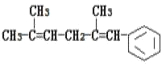 ,判断下列说法中不正确的是( )
,判断下列说法中不正确的是( )
A.它可以使酸性KMnO4溶液褪色
B.它可发生取代反应、加成反应、加聚反应、氧化反应
C.1mol该有机物完全燃烧消耗氧气为18.5mol
D.它与氢气发生加成反应,最多可以消耗5mol氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S是一种剧毒气体,如图为质子膜H2S燃料电池的示意图,可对H2S废气资源化利用。下列叙述错误的是

![]()
A. a是负极,电池工作时,电子的流动力向是:电极a-负载一电极b-质子膜一电极a
B. 电池工作时,化学能转化为电能和热能
C. 电极b上发生的电极反应式为O2+ 4e-+4H+=2H2O
D. 当电路中通过4mol电子时,有4molH+经质子膜进入正极区
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com