
【题目】已知某有机物的结构简式为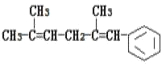 ,判断下列说法中不正确的是( )
,判断下列说法中不正确的是( )
A.它可以使酸性KMnO4溶液褪色
B.它可发生取代反应、加成反应、加聚反应、氧化反应
C.1mol该有机物完全燃烧消耗氧气为18.5mol
D.它与氢气发生加成反应,最多可以消耗5mol氢气
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
【题目】已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2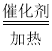 2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
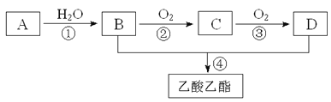
回答下列问题:
(1)写出A的电子式_______________________。
(2)B、D分子中的官能团名称分别是_______、________。
(3)写出下列反应的反应类型:①______,②______,④_____。
(4)写出下列反应的化学方程式:
①______________________________________;
②________________________________________;
④_________________________________________。
(5)现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图。请在图中圆括号内填入适当的试剂,在方括号内填入适当的分离方法。
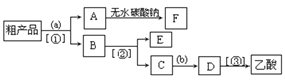
(Ⅰ)试剂a是__________,试剂b是_______________;
分离方法①是_________,分离方法②是____________,分离方法③是___________。
(Ⅱ)在得到的A中加入无水碳酸钠粉末,振荡,目的是______________。
(Ⅲ)写出C → D 反应的化学方程式________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究所对含硫酸亚铁和硫酸铜的工业废料进行相关的研究。实验过程如下:
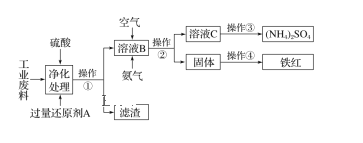
回答下列问题:
(1)滤渣的成分为______________,操作②的名称为____________。
(2)上图溶液B中所发生反应的离子方程式为_________________________________。
(3)实验要求先向溶液B中通入过量的空气,证明通入空气过量的方法是___________________
(4)操作③第一步需要的仪器除了酒精灯、铁架台外,还需要____________________________。
(5)某同学利用下面装置制备氢气并利用氢气还原某金属氧化物,根据要求回答问题。
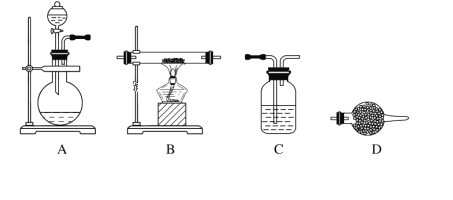
①请设计一个实验方案验证H2的还原性并检验其氧化产物,其装置连接顺序是A→________→________→________→D(除D装置外,其他装置不能重复使用),最后D装置中所加药品为________,其作用是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列叙述正确的是( )
A.1molFe溶于过量稀硝酸,电子转移数为2NA
B.标准状况下,2.24LCCl4含有分子的数目为0.1NA
C.46gNO2和N2O4混合气体中含有原子总数为3NA
D.1L0.1mol/L的NaHCO3溶液中,HCO3-、CO32-离子数之和为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表)。回答下列问题:
(1)氮原子价层电子对的轨道表达式(电子排布图)为_____________。
(2)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如图(a)所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因是___________;氮元素的E1呈现异常的原因是__________。
(3)经X射线衍射测得化合物R的晶体结构,其局部结构如图(b)所示。
①从结构角度分析,R中两种阳离子的相同之处为_________,不同之处为__________。(填标号)
A.中心原子的杂化轨道类型 B.中心原子的价层电子对数
C.立体结构 D.共价键类型
②R中阴离子N5-中的σ键总数为________个。分子中的大π键可用符号![]() 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为![]() ),则N5-中的大π键应表示为____________。
),则N5-中的大π键应表示为____________。
③图(b)中虚线代表氢键,其表示式为(NH4+)N-H┄Cl、____________、____________。

(4)R的晶体密度为d g·cm-3,其立方晶胞参数为a nm,晶胞中含有y个[(N5)6(H3O)3(NH4)4Cl]单元,该单元的相对质量为M,则y的计算表达式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据编号①~⑩代表的元素在周期表中的位置,回答下列问题:
Ⅰ | Ⅱ | Ⅲ | Ⅳ | Ⅴ | Ⅵ | Ⅶ | 0 | |
1 | ① | ② | ||||||
2 | ③ | ④ | ⑤ | ⑥ | ||||
3 | ⑦ | ⑧ | ⑨ | ⑩ |
(1)能显+1价,还能显-1价的元素是____(填元素符号):②的分子式是____
(2)⑥与⑦按原子个数比1:1形成化合物甲,其电子式为____,向甲中滴加足量水时发生反应的化学方程式是____
(3)⑦、⑧、⑨三种元素最高价氧化物对应的水化物,碱性由强到弱的顺序排列为____(填化学式);⑩的最高价氧化物对应的水化物的化学式为____
(4)①、⑤、⑥三种元素形成的一种常见盐的化学式为____/span>,其中含有的化学键为____
(5)高温灼烧由⑦与⑩形成的化合物时,火焰呈____色。⑧可用于航空航天合金材料的制备,工业上冶炼该单质的化学方程式为____
(6)元素⑨的单质和⑦的最高价氧化物的水化物之间发生反应的离子方程式为____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl是应用广泛的有机合成催化剂,也在染料工业中用作实效型气体吸收剂。利用废旧印刷电路板制氯化亚铜可减少污染、实现资源再生。请回答下列问题:
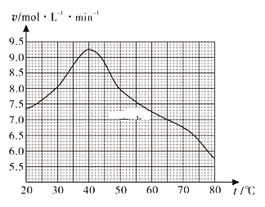
(1)废旧印刷电路板经粉碎分离能得到金属粉末,控制其他条件相同,用10%H2O2和3.0mol·L-1 H2SO4的混合溶液处理印刷电路板的金属粉末,测得不同温度下铜的平均溶解速率如图所示。在H2SO4溶液中,Cu与H2O2反应生成Cu2+和H2O的离子方程式为______。当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是______。
(2)工业上常用CuSO4来制备CuCl。在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl,加热,生成CuCl沉淀,该反应的离子方程式是__________。
(3)在盐酸中CuCl能吸收CO,发生的反应为 CuCl+CO+H2O![]() Cu(CO)Cl·H2O H<0,要加大CO的吸收率,适宜的条件是_____________。
Cu(CO)Cl·H2O H<0,要加大CO的吸收率,适宜的条件是_____________。
(4)工业制备CuCl需要配制质量分数为20.0%的CuSO4溶液(密度为1.2g·cm-3),配制该溶液所需CuSO4·5H2O与H2O的质量之比为_______,所得溶液的物质的量浓度为______。
(5)工业检测CuCl产品的纯度需要80mL0.5mol/L的FeCl3溶液,配制该溶液所需仪器除托盘天平(含砝码、质量相同的两纸片)、烧杯外,还必需___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,二元弱酸 H2Y 溶液中滴加 KOH 溶液,所得混合溶液的 pH 与离子浓度变化的关系如下图所示,下列有关说法错误的是

A. 曲线 M 表示 pH与 lg![]() 的变化关系
的变化关系
B. a点溶液中:c(H+) ― c(OH-)=2c(Y2-)+c(HY-) ― c(K+)
C. H2Y 的第二级电离常数Ka2(H2Y)=10-4.3
D. 交点b的溶液中:c(H2Y)=c(Y2-)>c(HY-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里用二氧化锰与浓盐酸反应来制取适量的氯气。现用100mL的浓盐酸与二氧化锰反应,生成的氯气在标准状况时的体积为5.6升,计算:
(1)理论上需要参加反应的二氧化锰_______克?
(2)浓盐酸的物质的量浓度为_____________?
(3)被氧化的HCl的质量为______________克?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com