
【题目】已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2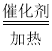 2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
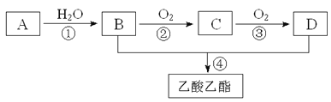
回答下列问题:
(1)写出A的电子式_______________________。
(2)B、D分子中的官能团名称分别是_______、________。
(3)写出下列反应的反应类型:①______,②______,④_____。
(4)写出下列反应的化学方程式:
①______________________________________;
②________________________________________;
④_________________________________________。
(5)现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图。请在图中圆括号内填入适当的试剂,在方括号内填入适当的分离方法。
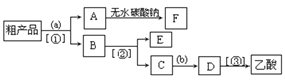
(Ⅰ)试剂a是__________,试剂b是_______________;
分离方法①是_________,分离方法②是____________,分离方法③是___________。
(Ⅱ)在得到的A中加入无水碳酸钠粉末,振荡,目的是______________。
(Ⅲ)写出C → D 反应的化学方程式________________________________。
【答案】![]() 羟基 羧基 加成 氧化 取代(酯化) CH2=CH2+H2O
羟基 羧基 加成 氧化 取代(酯化) CH2=CH2+H2O![]() CH3CH2OH 2CH3CH2OH+O2
CH3CH2OH 2CH3CH2OH+O2![]() 2CH3CHO+2H2O CH3COOH+C2H5OH
2CH3CHO+2H2O CH3COOH+C2H5OH![]() CH3COOC2H5+H2O 饱和Na2CO3溶液 稀硫酸 分液 蒸馏 蒸馏 吸收水份,得到纯净的乙酸乙酯 2CH3COONa + H2SO4=2CH3COOH + Na2SO4
CH3COOC2H5+H2O 饱和Na2CO3溶液 稀硫酸 分液 蒸馏 蒸馏 吸收水份,得到纯净的乙酸乙酯 2CH3COONa + H2SO4=2CH3COOH + Na2SO4
【解析】
A的产量是衡量一个国家石油化工生产水平的标志,则A是乙烯。乙烯含有碳碳双键,能和水发生加成反应生成乙醇,即B是乙醇。乙醇发生催化氧化生成乙醛,则C是乙醛。乙醛氧化生成乙酸,则D是乙酸,乙醇和乙酸发生酯化反应生成乙酸乙酯。
由于生成的乙酸乙酯中含有乙酸和乙醇,则试剂a是饱和碳酸钠溶液,分液即可实现乙酸乙酯的分离,A干燥即得到乙酸乙酯,所以F是乙酸乙酯。B中含有乙酸钠和乙醇以及碳酸钠,则通过蒸馏即得到乙醇,所以E是乙醇。C中含有乙酸钠和碳酸钠,则加入稀硫酸即生成乙酸,然后蒸馏得到乙酸。
(1)A是乙烯,结构简式为CH2=CH2,电子式为![]() 。
。
(2)B是乙醇,官能团为羟基,D是乙酸,官能团为羧基。
(3)反应①是乙烯和水的加成反应,②是乙醇的催化氧化反应,④是乙酸和乙醇的酯化反应,也是取代反应。
(4)反应①是乙烯和水的加成反应:CH2=CH2+H2O![]() CH3CH2OH;
CH3CH2OH;
②是乙醇的催化氧化反应:2CH3CH2OH+O2![]() 2CH3CHO+2H2O;
2CH3CHO+2H2O;
④是乙酸和乙醇的酯化反应:CH3COOH+C2H5OH![]() CH3COOC2H5+H2O。
CH3COOC2H5+H2O。
(5)现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图。请在图中圆括号内填入适当的试剂,在方括号内填入适当的分离方法。
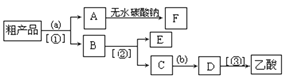
(Ⅰ)由以上分析可知,试剂a是饱和碳酸钠溶液,试剂b是稀硫酸;分离方法①是分液,分离方法②和③都是蒸馏。
(Ⅱ)无水碳酸钠粉末具有吸水性,可以吸收乙酸乙酯中的水分,得到干燥的乙酸乙酯。
(Ⅲ)C → D 是加入稀硫酸,把乙酸钠重新转变为乙酸,反应的化学方程式为2CH3COONa + H2SO4=2CH3COOH + Na2SO4。


科目:高中化学 来源: 题型:
【题目】已知酸性:苯甲酸>碳酸>苯酚,现将![]() 转变为
转变为![]() 的方法为( )
的方法为( )
A.与稀H2SO4共热后,加入足量的Na2CO3
B.加入足量的NaOH溶液,再通入足量的HCl
C.与足量的NaOH溶液共热后,再通入CO2
D.与稀H2SO4共热后,加入足量的NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,向某容积可变的密闭容器中充入1 mol N2和3 mol H2发生反应: N2+3H2![]() 2NH3。下列说法不正确的是
2NH3。下列说法不正确的是
A.升高温度能加快化学反应速率
B.增大体积能减慢化学反应速率
C.充分反应后生成NH3的物质的量小于2 mol
D.达到化学平衡状态时,v(H2)正=v(NH3)逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】著名的获得诺贝尔奖的狄尔斯![]() 阿德尔反应,是由共轭双烯与烯烃或炔烃反应生成六元环的反应。如:CH2=CH-CH=CH2+CH2=CH2
阿德尔反应,是由共轭双烯与烯烃或炔烃反应生成六元环的反应。如:CH2=CH-CH=CH2+CH2=CH2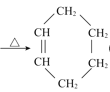
![]() 可表示为
可表示为![]()
![]() ,实际是个加成反应。工业上常用下列流程制取重要化学原料
,实际是个加成反应。工业上常用下列流程制取重要化学原料![]() (M)。
(M)。

流程中的A为天然橡胶的单体,分子式为C5H8。
(1)A的名称是___,B的结构简式是___。
(2)A的属于炔烃的同分异构体一共有___种,A与B反应生成的另一种含六元环的化合物的结构简式为___。
(3)②反应的类型为___,③反应的化学方程式为:___。
(4)按下列要求写出B的两种同分异构体的结构简式:___。
(Ⅰ)能发生银镜反应;(Ⅱ)分子结构中含有两个甲基;(Ⅲ)能发生水解反应
由丙烯制得B经如下流程:CH3-CH=CH2![]() CH3CHClCH2Cl
CH3CHClCH2Cl![]() C→X→Y→Z→CH2=CH-COOH
C→X→Y→Z→CH2=CH-COOH![]() B
B
(5)参照流程中的前两步和最后一步的书写方法写出其他中间步骤的流程:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列各组物质:
①乙烯和2-丁烯;
②CH4和![]() ;
;
③CH3CH2OH和CH3—O—CH3;
④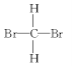 和
和 ;
;
⑤CH2=CH—CH=CH2和CH3C≡CCH3;
⑥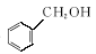 和
和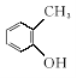 ;
;
⑦![]() C和
C和![]() C;
C;
⑧O2与O3;
⑨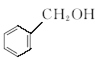 与
与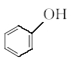
试回答下列问题:
(1)每组中的物质互为同分异构体的是_________(填编号,下同)。
(2)每组中的物质互为同系物的是_____。
(3)每组中的物质属于同一物质的是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳元素不仅能形成丰富多彩的有机化合物,而且还能形成多种无机化合物如C,同时自身可以形成多种单质如D和E,碳及其化合物的用途广泛。
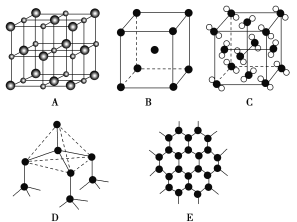
已知A为离子晶体,B为金属晶体,C为分子晶体
(1)图中分别代表了五种常见的晶体,分别是:A________,B________,C________,D________,E________。(填名称或化学式)
(2)干冰和冰是两种常见的分子晶体,关于两种晶体的比较中正确的是_____。
a.晶体的密度:干冰>冰 b.晶体的熔点:干冰>冰
c.晶体中的空间利用率:干冰>冰 d.晶体中分子间相互作用力类型相同
(3) 金刚石和石墨是碳的两种常见单质,下列叙述正确的有________。
a.金刚石中碳原子的杂化类型为sp3杂化,石墨中碳原子的杂化类型为sp2杂化
b.晶体中共价键的键长:金刚石中C—C<石墨中C—C
c.晶体的熔点:金刚石>石墨
d.晶体中共价键的键角:金刚石>石墨
e.金刚石晶体中只存在共价键,石墨晶体中则存在共价键、金属键和范德华力
f.金刚石和石墨的熔点都很高,所以金刚石和石墨都是原子晶体
(4)金刚石晶胞结构如图,一个晶胞中的C原子数目为 ________。
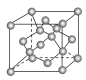
(5)C与孔雀石共热可以得到金属铜,金属铜采用面心立方最密堆积,已知Cu单质的晶体密度为ρ g/cm3,Cu的相对原子质量为M,阿伏加德罗常数为NA,则Cu的原子半径为 __________cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气中氮氧化物和碳氢化合物受紫外线作用可产生一次污染物——光化学烟雾,其中部分物质的反应过程如图所示。下列说法正确的是( )

A.该过程中![]() 作催化剂B.反应过程中没有电子转移
作催化剂B.反应过程中没有电子转移
C.反应过程中氮氧化物不断被消耗D.丙烯转化为甲醛和乙醛
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mLNaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入0.2mol·L-1的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。
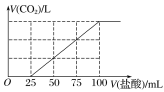
下列判断正确的是( )
A.所得溶液的溶质成分为NaOH和Na2CO3
B.所得溶液的溶质成分为NaHCO3和Na2CO3
C.原NaOH溶液的浓度为0.1mol·L-1
D.通入CO2在标准状况下的体积为448mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物的结构简式为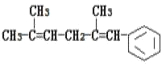 ,判断下列说法中不正确的是( )
,判断下列说法中不正确的是( )
A.它可以使酸性KMnO4溶液褪色
B.它可发生取代反应、加成反应、加聚反应、氧化反应
C.1mol该有机物完全燃烧消耗氧气为18.5mol
D.它与氢气发生加成反应,最多可以消耗5mol氢气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com