
【题目】电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
Ⅰ. 已知部分弱酸的电离常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离常数(25℃) | Ka= 1.77×10-4 | Ka=4.3×l0-10 | Ka1=5.0×l0-7Ka2=5.6×l0-11 |
(1)0.1 moI/L NaCN溶液和0.1mol/L NaHCO3溶液中,c(CN-)______c(HCO3 -)(填“>”、“<”或“=”)。
(2)常温下,pH相同的三种溶液A.HCOONa B.NaCN C.Na2CO3,其物质的量浓度由大到小的顺序是________(填编号)。
(3)室温下,—定浓度的HCOONa溶液pH =9,用离子方程式表示溶液呈碱性的原因是___________。
Ⅱ. 室温下,用0.100 mol/L盐酸溶液滴定20.00mL0.l00mol/L 的某氨水溶液,滴定曲线如图所示。

(4)d点所示的溶液中离子浓度由大到小的顺序依次为_______________。
(5)b点所示的溶液中c(NH3·H2O) - c(NH4+)=______(用溶液中的其它离子浓度表示)。
Ⅲ. 已知Ksp(BaCO3) =2.6×l0-9,Ksp( BaSO4)=1.1×10-10.
(6)向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时,溶液中![]() =___________(保留三位有效数字)。
=___________(保留三位有效数字)。
【答案】< ABC HCOO-+H2O![]() HCOOH+OH- c(C1-)>c(NH4+)>c(H+)>c(OH-) )2 c(H+)-2c(OH-) 23.6
HCOOH+OH- c(C1-)>c(NH4+)>c(H+)>c(OH-) )2 c(H+)-2c(OH-) 23.6
【解析】
(1)酸的电离平衡常数越大,酸的酸性越强,其对应的酸根离子水解程度越小;
(2)常温下,酸的电离平衡常数越大,酸的酸性越强,其对应的酸根离子水解程度越小,
(3)室温下,一定浓度的![]() 溶液pH=9,甲酸钠是强碱弱酸盐,
溶液pH=9,甲酸钠是强碱弱酸盐,![]() 水解导致溶液呈碱性;
水解导致溶液呈碱性;
(4)d点酸碱恰好完全反应生成氯化铵,氯化铵水解导致溶液呈酸性,![]() ,结合电荷守恒得
,结合电荷守恒得![]() ,水解程度较小;
,水解程度较小;
(5)b点溶液为含等物质的量的氯化铵和一水合氨的混合溶液,根据电荷守恒和物料守恒得质子守恒;
(6)根据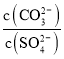 =
=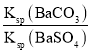 计算。
计算。
(1)酸的电离平衡常数越大,酸的酸性越强,其对应的酸根离子水解程度越小,根据表中数据知,酸的电离平衡常数:![]() ,则水解程度:
,则水解程度:![]() ,酸根离子水解程度越大,其水溶液中酸根离子浓度越小,所以存在
,酸根离子水解程度越大,其水溶液中酸根离子浓度越小,所以存在![]() ;
;
故答案为:<;
(2)常温下,酸的电离平衡常数越大,酸的酸性越强,其对应的酸根离子水解程度越小,浓度相同时水解程度:![]() ,故pH相同的
,故pH相同的![]() ,浓度由大到小的顺序是
,浓度由大到小的顺序是![]() ;
;
故答案为:ABC;
(3)室温下,一定浓度的![]() 溶液pH=9,甲酸钠是强碱弱酸盐,
溶液pH=9,甲酸钠是强碱弱酸盐,![]() 水解导致溶液呈碱性,水解离子方程式为:
水解导致溶液呈碱性,水解离子方程式为:![]() ;
;
故答案为:![]() ;
;
(4)d点酸碱恰好完全反应生成氯化铵,氯化铵水解导致溶液呈酸性,![]() ,结合电荷守恒得
,结合电荷守恒得![]() ,水解程度较小,d点所示的溶液中离子浓度由大到小的顺序
,水解程度较小,d点所示的溶液中离子浓度由大到小的顺序![]() ;
;
故答案为:![]() ;
;
(5)b点溶液为含等物质的量的氯化铵和一水合氨的混合溶液,故b点溶液中存在电荷守恒![]() ,存在物料守恒
,存在物料守恒![]() ,所以得
,所以得![]() ,则
,则![]() ,
,
故答案为:![]() ;
;
(6)向含有![]() 固体的溶液中滴加
固体的溶液中滴加![]() 溶液,当有
溶液,当有![]() 沉淀生成时,
沉淀生成时,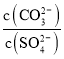 =
=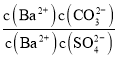 =
=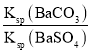 =
=![]() =23.6;
=23.6;
故答案为:23.6。


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】化学与人们的日常生活密切相关,下列叙述正确的是![]()
A.水玻璃可用于生产黏合剂和防火剂
B.纤维素、油脂是天然有机高分子化合物
C.白菜上洒少许福尔马林,既保鲜又消毒
D.棉、麻、合成纤维完全燃烧都只生成![]() 和
和![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别取1 molA、B、C、D、E、F六种有机物,使它们充分燃烧,都生成44.8LCO2(标况),D和E是碳、氢、氧的化合物,两者互为同分异构体,E被氧化成A,A继续氧化成B,C、F都能发生加聚反应,C和氯化氢加成生成F。试推断有机化合物A、B、C、D、E、F的结构简式。
(1)A.______、B.______、C.______、D.______、E.______、F.______。
(2)写出下列反应的化学方程式
E→A:_________________________________________。
实验室制备C:__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①:2C(s)+O2(g)═2CO(q)△H=﹣221.0kJ/mol②2H2(q)+O2(q)═2H2O(g)△H=﹣483.6kJ/mol,则制备水煤气的反应C(s)+H2O(g)═CO(g)+H2(g)的△H为( )
A.262.6kJ/mol B.﹣131.3kJ/mol C.﹣352.3kJ/mol D.+131.3kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】建构数学模型来研究化学问题,既直观又简洁,下列建构的数轴模型正确的是( )
A.钠在氧气中燃烧,钠的氧化产物:![]()
B.铁在Cl2中燃烧,铁的氧化产物:![]()
C.A1C13溶液中滴加NaOH溶液后体系中铝元素的存在形式:![]()
D.FeI2溶液中通入Cl2,铁元素存在形式:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾天气多次肆虐我国中东部地区。其中汽车尾气和燃煤尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和 时间(t)的变化曲线如图1所示。
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和 时间(t)的变化曲线如图1所示。
据此判断:
①该反应的ΔH____0(填“>”或“<”)。
②在T1温度下,0~2 s内的平均反应速率υ(N2)=_____。
③当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若增大催化剂的表面积,则CO转化率____(填“增大”“减小”或“不变”)。
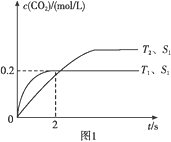
④若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是____(填字母)。

(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
例如:CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g)ΔH=-867.0 kJ/mol
2NO2(g)![]() N2O4(g) ΔH=-56.9 kJ/mol
N2O4(g) ΔH=-56.9 kJ/mol
写出CH4催化还原N2O4(g)生成N2、CO2和H2O(g)的热化学方程式:_________________。
(3)工业上用CO2和H2反应合成二甲醚:2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g) △H3 = -130.8 kJ/mol
CH3OCH3(g)+3H2O(g) △H3 = -130.8 kJ/mol
①一定条件下,上述反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是______________ (填代号)。
a.逆反应速率先增大后减小
b. H2的转化率增大
c.反应物的体积百分含量减小
d.容器中 ![]() 值变小
值变小
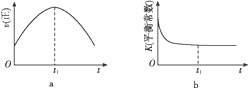
②在某压强下,合成二甲醚的反应在不同温度、不同投料比时,CO2的转化率如图2所示。KA、KB、Kc三者由大到小的关系是_____________________.

③上述合成二甲醚的过程中提高CO2的转化率可采取的措施有__________________、__________________(回答2点)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置进行下列实验,能得出相应实验结论的是

选项 | ① | ② | ③ | 实验结论 |
A | 浓氨水 | NaOH | 酚酞试液 | 碱性:NaOH>NH3·H2O |
B | 浓硫酸 | 蔗糖 | 品红溶液 | 浓硫酸具有脱水性、氧化性 |
C | 稀盐酸 | Na2SO3 | Ba(NO3)2溶液 | SO2与可溶性钡盐反应均可生成白色沉淀 |
D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从某含Br—废水中提取Br2的过程包括:过滤、氧化、萃取(需选择合适萃取剂)及蒸馏等步骤。已知:
物质 | Br2 | CCl4 | 正十二烷 |
密度/g·cm-3 | 3.119 | 1.595 | 0.753 |
沸点/℃ | 58.76 | 76.8 | 215~217 |
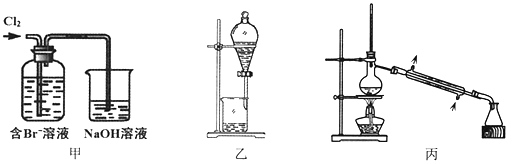
下列说法不正确的是
A. 甲装置中Br—发生的反应为:2Br-+ Cl2 = Br2 + 2Cl-
B. 甲装置中NaOH溶液每吸收0.1mol Cl2,转移0.1mol e—
C. 用乙装置进行萃取,溶解Br2的有机层在下层
D. 用丙装置进行蒸馏,先收集到的是Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室模拟“间接电化学氧化法”处理氨氮废水。以硫酸铵和去离子水配制成初始的模拟废水,并以NaCl调剂溶液中氯离子浓度,如图所示进行模拟实验。
(1)阳极反应式为___。
(2)去除NH4+的离子反应方程式为___。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com