
ЁОЬтФПЁПЗжБ№ШЁ1 molAЁЂBЁЂCЁЂDЁЂEЁЂFСљжжгаЛњЮяЃЌЪЙЫќУЧГфЗжШМЩеЃЌЖМЩњГЩ44.8LCO2(БъПі)ЃЌDКЭEЪЧЬМЁЂЧтЁЂбѕЕФЛЏКЯЮяЃЌСНепЛЅЮЊЭЌЗжвьЙЙЬхЃЌEБЛбѕЛЏГЩAЃЌAМЬајбѕЛЏГЩBЃЌCЁЂFЖМФмЗЂЩњМгОлЗДгІЃЌCКЭТШЛЏЧтМгГЩЩњГЩFЁЃЪдЭЦЖЯгаЛњЛЏКЯЮяAЁЂBЁЂCЁЂDЁЂEЁЂFЕФНсЙЙМђЪНЁЃ
(1)AЃЎ______ЁЂBЃЎ______ЁЂCЃЎ______ЁЂDЃЎ______ЁЂEЃЎ______ЁЂFЃЎ______ЁЃ
(2)аДГіЯТСаЗДгІЕФЛЏбЇЗНГЬЪН
EЁњAЃК_________________________________________ЁЃ
ЪЕбщЪвжЦБИCЃК__________________________________ЁЃ
ЁОД№АИЁПCH3CHO CH3COOH CH![]() CH CH3OCH3 CH3CH2OH CH2=CHCl 2CH3CH2OH+O2
CH CH3OCH3 CH3CH2OH CH2=CHCl 2CH3CH2OH+O2![]() 2CH3CHO+2H2O CaC2+2H2OЁњCa(OH)2+CHЁдCHЁќ
2CH3CHO+2H2O CaC2+2H2OЁњCa(OH)2+CHЁдCHЁќ
ЁОНтЮіЁП
ЪзЯШИљОнn=![]() МЦЫуCO2ЕФЮяжЪЕФСПЃЌШЛКѓИљОнAЁЂBЁЂCЁЂDЁЂEЁЂFСљжжгаЛњЮяЗжзгжаКЌгаCдзгЪ§ФПЮЊ2ЃЌИљОнЮяжЪЕФаджЪМАзЊЛЏЙиЯЕЃЌЭЦГіИїжжЮяжЪЕФНсЙЙЃЌВЂЪщаДГіЯргІЗДгІЕФЛЏбЇЗНГЬЪНЁЃ
МЦЫуCO2ЕФЮяжЪЕФСПЃЌШЛКѓИљОнAЁЂBЁЂCЁЂDЁЂEЁЂFСљжжгаЛњЮяЗжзгжаКЌгаCдзгЪ§ФПЮЊ2ЃЌИљОнЮяжЪЕФаджЪМАзЊЛЏЙиЯЕЃЌЭЦГіИїжжЮяжЪЕФНсЙЙЃЌВЂЪщаДГіЯргІЗДгІЕФЛЏбЇЗНГЬЪНЁЃ
дкБъзМзДПіЯТ44.8LCO2ЕФЮяжЪЕФСПn(CO2)=![]() =2molЃЌгЩгк1 molAЁЂBЁЂCЁЂDЁЂEЁЂFСљжжгаЛњЮяШМЩеЖМВњЩњ2molCO2ЃЌЫљвдAЁЂBЁЂCЁЂDЁЂEЁЂFСљжжгаЛњЮяЗжзгжаКЌгаCдзгЪ§ФПЮЊ2molЁТ1mol=2ЃЌEБЛбѕЛЏГЩAЃЌAМЬајбѕЛЏГЩBЃЌдђEКЌга-OHЁЂAКЌга-CHOЁЂBКЌга-COOHЃЌEЪЧЬМЁЂЧтЁЂбѕШ§жждЊЫиЕФЛЏКЯЮяЃЌдђEЮЊввДМЁЂAЮЊввШЉЁЂBЮЊввЫсЃЌDКЭEСНепЛЅЮЊЭЌЗжвьЙЙЬхЃЌDЮЊЖўМзУбЃЌCКЭFЖМЗЂЩњОлКЯЗДгІЃЌCКЭHClМгГЩЩњГЩFЃЌЫЕУїCгыFЖМКЌгаВЛБЅКЭМќЃЌвђДЫCЮЊввШВЃЌFЮЊТШввЯЉЁЃ
=2molЃЌгЩгк1 molAЁЂBЁЂCЁЂDЁЂEЁЂFСљжжгаЛњЮяШМЩеЖМВњЩњ2molCO2ЃЌЫљвдAЁЂBЁЂCЁЂDЁЂEЁЂFСљжжгаЛњЮяЗжзгжаКЌгаCдзгЪ§ФПЮЊ2molЁТ1mol=2ЃЌEБЛбѕЛЏГЩAЃЌAМЬајбѕЛЏГЩBЃЌдђEКЌга-OHЁЂAКЌга-CHOЁЂBКЌга-COOHЃЌEЪЧЬМЁЂЧтЁЂбѕШ§жждЊЫиЕФЛЏКЯЮяЃЌдђEЮЊввДМЁЂAЮЊввШЉЁЂBЮЊввЫсЃЌDКЭEСНепЛЅЮЊЭЌЗжвьЙЙЬхЃЌDЮЊЖўМзУбЃЌCКЭFЖМЗЂЩњОлКЯЗДгІЃЌCКЭHClМгГЩЩњГЩFЃЌЫЕУїCгыFЖМКЌгаВЛБЅКЭМќЃЌвђДЫCЮЊввШВЃЌFЮЊТШввЯЉЁЃ
(1)ИљОнЩЯЪіЗжЮіПЩжЊЃКAЪЧввШЉЃЌAНсЙЙМђЪНЮЊCH3CHOЃЛBЮЊввЫсЃЌНсЙЙМђЪНЮЊCH3COOHЃЛCЮЊввШВЃЌНсЙЙМђЪНЮЊCHЁдCHЃЛDЮЊЖўМзУбЃЌНсЙЙМђЪНЮЊCH3OCH3ЃЛEЮЊввДМЃЌНсЙЙМђЪНЮЊCH3CH2OHЃЛFЮЊТШввЯЉЃЌНсЙЙМђЪНЮЊCH2=CHClЃЛ
(2)EЮЊCH3CH2OHЃЌКЌгаєЧЛљЃЌгыO2дкДпЛЏМСДцдкЕФЬѕМўЯТМгШШЃЌЗЂЩњбѕЛЏЗДгІввШЉЃЌИУЗДгІЕФЛЏбЇЗНГЬЪНЮЊЃК2CH3CH2OH+O2![]() 2CH3CHO+2H2OЃЛCЮЊввШВCHЁдCHЃЌдкЪЕбщЪвжаЪЧгУЕчЪЏCaC2гыH2OЗДгІжЦШЁЕФЃЌЗДгІЗНГЬЪНЮЊЃКCaC2+2H2OЁњCa(OH)2+CHЁдCHЁќЁЃ
2CH3CHO+2H2OЃЛCЮЊввШВCHЁдCHЃЌдкЪЕбщЪвжаЪЧгУЕчЪЏCaC2гыH2OЗДгІжЦШЁЕФЃЌЗДгІЗНГЬЪНЮЊЃКCaC2+2H2OЁњCa(OH)2+CHЁдCHЁќЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдкУмБеШнЦїжавЛЖЈСПЕФЛьКЯЦјЬхЗЂЩњЗДгІxA(g)+yB(g)![]() zC(g)ЃЌЦНКтЪБВтЕУAЕФХЈЖШЮЊ0.50 mol/LЁЃБЃГжЮТЖШВЛБф.НЋШнЦїЕФШнЛ§РЉДѓЕНдРДЕФСНБЖЃЌдйДяЦНКтЪБЃЌВтЕУAЕФХЈЖШНЕЕЭЮЊ0.30 mol/LЁЃЯТСагаЙиХаЖЯе§ШЗЕФЪЧ
zC(g)ЃЌЦНКтЪБВтЕУAЕФХЈЖШЮЊ0.50 mol/LЁЃБЃГжЮТЖШВЛБф.НЋШнЦїЕФШнЛ§РЉДѓЕНдРДЕФСНБЖЃЌдйДяЦНКтЪБЃЌВтЕУAЕФХЈЖШНЕЕЭЮЊ0.30 mol/LЁЃЯТСагаЙиХаЖЯе§ШЗЕФЪЧ
A.BЕФзЊЛЏТЪНЕЕЭB.ЦНКтЯђе§ЗДгІЗНЯђвЦЖЏ
C.x+y<zD.CЕФЬхЛ§ЗжЪ§діДѓ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП![]() КЯРэЩХЪГЃЌБЃГжгЊбјОљКтЃЌЪЧЧрЩйФъбЇЩњНЁПЕГЩГЄЕФживЊБЃжЄЃЎ
КЯРэЩХЪГЃЌБЃГжгЊбјОљКтЃЌЪЧЧрЩйФъбЇЩњНЁПЕГЩГЄЕФживЊБЃжЄЃЎ
ЂйЯТУцЪГЦзгЊбјДюХфзюОљКтЕФЪЧ ______
A СЙАшЧрВЫЁЂЭСЖЙЫПЁЂТјЭЗ![]() ЬЧДзХХЙЧЁЂЧхеєідгуЁЂУзЗЙ
ЬЧДзХХЙЧЁЂЧхеєідгуЁЂУзЗЙ ![]() ЯКШЪАзВЫЁЂКьЩеДјгуЁЂЫсВЫьРжэЬуЁЂТмВЗЬР
ЯКШЪАзВЫЁЂКьЩеДјгуЁЂЫсВЫьРжэЬуЁЂТмВЗЬР ![]() НДХЃШтЁЂГДЧрВЫЁЂКьЩеЖЙИЏЁЂЮїКьЪСЕАЬРЁЂТјЭЗ
НДХЃШтЁЂГДЧрВЫЁЂКьЩеЖЙИЏЁЂЮїКьЪСЕАЬРЁЂТјЭЗ
ЂкЧрЩйФъМАГЩШЫШБЗІФГжжЮЂСПдЊЫиНЋЕМжТМззДЯйжзДѓЃЌЖјЧвЛсдьГЩжЧСІЫ№КІЃЌИУЮЂСПдЊЫиЪЧ ______ ![]() ЬюзжФИ
ЬюзжФИ![]()
![]() Ет
Ет![]() Ьњ
Ьњ![]() ИЦ
ИЦ
ЂлЕААзжЪЪЧШЫЬхБиашЕФгЊбјЮяжЪЃЌЫќдкШЫЬхФкзюжеЗжНтЮЊ ______ ![]() ЬюзжФИ
ЬюзжФИ![]() ЃЎ
ЃЎ
A ЦЯЬбЬЧ![]() АБЛљЫс
АБЛљЫс![]() жЌЗОЫс
жЌЗОЫс
ЂмЙњМвЭЦЙу ______ вдВЙЬњЃЎШБЬњЛсдьГЩ ______
![]() ВФСЯЪЧШЫРрЩњДцКЭЗЂеЙЕФЮяжЪЛљДЁЃЌКЯРэЪЙгУВФСЯПЩвдИФЩЦЮвУЧЕФЩњЛюЃЎ
ВФСЯЪЧШЫРрЩњДцКЭЗЂеЙЕФЮяжЪЛљДЁЃЌКЯРэЪЙгУВФСЯПЩвдИФЩЦЮвУЧЕФЩњЛюЃЎ
ЂйОгЪвзАаоЫљЪЙЕФШЫдьАхВФЛсЪЭЗХГівЛжжЛгЗЂадЮяжЪЃЌГЄЦкНгДЅЛсв§Ц№Й§УєадЦЄбзЃЌУтвпЙІФмвьГЃЃЌИУЛгЗЂадЮяжЪЪЧ ______ ![]() ЬюзжФИ
ЬюзжФИ![]() ОЦОЋ
ОЦОЋ![]() есЬЧ
есЬЧ![]() МзШЉ
МзШЉ
ЂкВЃСЇЪЧживЊЕФЙшЫсбЮВњЦЗЃЎЩњВњВЃСЇЪБЃЌЪЏЛвЪЏгыЪЏгЂЗДгІЕФЛЏбЇЗНГЬЪНЮЊ ______ ЃЎ
![]() БЃГжНрОЛАВШЋЕФЩњДцЛЗОГвбГЩЮЊШЋШЫРрЕФЙВЪЖЃЌШЫгыздШЛвЊКЭаГЯрДІЃЎЖдЦћГЕМгзАЮВЦјДпЛЏОЛЛЏзАжУЃЌПЩвдЪЙЦфжаЕФNOЁЂCOЯрЛЅЗДгІзЊЛЏГЩЮоЖОЕФЦјЬхЃЌЦфдРэПЩвдгУЛЏбЇЗНГЬЪНБэЪОЮЊ ______ ЃЎ
БЃГжНрОЛАВШЋЕФЩњДцЛЗОГвбГЩЮЊШЋШЫРрЕФЙВЪЖЃЌШЫгыздШЛвЊКЭаГЯрДІЃЎЖдЦћГЕМгзАЮВЦјДпЛЏОЛЛЏзАжУЃЌПЩвдЪЙЦфжаЕФNOЁЂCOЯрЛЅЗДгІзЊЛЏГЩЮоЖОЕФЦјЬхЃЌЦфдРэПЩвдгУЛЏбЇЗНГЬЪНБэЪОЮЊ ______ ЃЎ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊЗДгІCO(g)+H2O(g)![]() CO2(g)+H2(g) ЁїH<0ЃЌдквЛЖЈЮТЖШКЭбЙЧПЯТгкУмБеШнЦїжаЃЌЗДгІДяЕНЦНКтЁЃЯТСаа№Ъіе§ШЗЕФЪЧЃЈ ЃЉ
CO2(g)+H2(g) ЁїH<0ЃЌдквЛЖЈЮТЖШКЭбЙЧПЯТгкУмБеШнЦїжаЃЌЗДгІДяЕНЦНКтЁЃЯТСаа№Ъіе§ШЗЕФЪЧЃЈ ЃЉ
A.Щ§ИпЮТЖШЃЌn(CO)МѕЩйB.МѕаЁбЙЧПЃЌn(CO2)діМг
C.ИќЛЛИпаЇДпЛЏМСЃЌCOЕФзЊЛЏТЪдіДѓD.ГфШывЛЖЈСПЕФЕЊЦјЃЌn(H2)ВЛБф
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊдк25ЁцЃЌ101kPaЯТЃЌ1gC8H18ЃЈаСЭщЃЉШМЩеЩњГЩЖўбѕЛЏЬМКЭвКЬЌЫЎЪБЗХГі48.4kJШШСПЁЃБэЪОЩЯЪіЗДгІЕФШШЛЏбЇЗНГЬЪНе§ШЗЕФЪЧЃЈ ЃЉ
A.C8H18(l)+![]() O2(g)=8CO2(g)+9H2O(g) ЁїH=-48.4kJЁЄmol-1
O2(g)=8CO2(g)+9H2O(g) ЁїH=-48.4kJЁЄmol-1
B.C8H18(l)+![]() O2(g)=8CO2(g)+9H2O(l) ЁїH=-5517.6kJЁЄmol-1
O2(g)=8CO2(g)+9H2O(l) ЁїH=-5517.6kJЁЄmol-1
C.C8H18(l)+![]() O2(g)=8CO2(g)+9H2O(l) ЁїH=+5517.6kJЁЄmol-1
O2(g)=8CO2(g)+9H2O(l) ЁїH=+5517.6kJЁЄmol-1
D.C8H18(l)+![]() O2(g)=8CO2(g)+9H2O(l) ЁїH=-48.4kJЁЄmol-1
O2(g)=8CO2(g)+9H2O(l) ЁїH=-48.4kJЁЄmol-1
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПИљОнЯТСаЪЕбщВйзїКЭЯжЯѓЫљЕУГіЕФНсТле§ШЗЕФЪЧ
бЁЯю | ЪЕбщВйзїКЭЯжЯѓ | Нс Тл |
A | ЯђвЛЖЈХЈЖШЕФNa2SiO3 ШмвКжаЭЈШыЪЪСПCO2 ЦјЬхЃЌ ГіЯжАзЩЋГСЕэЁЃ | H2SiO3 ЕФЫсадБШH2CO3ЕФЫсадЧП |
B | НЋЩйСПFe(NO3)2МгЫЎШмНтКѓЃЌЕЮМгЯЁСђЫсЫсЛЏЃЌдйЕЮМгKSCNШмвКЃЌШмвКБфГЩбЊКьЩЋ | Fe(NO3)2вбБфжЪ |
C | ЪвЮТЯТЃЌВтЕУЃК0.1molЁЄL-1 Na2SO3ШмвКЕФpHдМЮЊ10ЃЛ0.1molЁЄL-1 NaHSO3ШмвКЕФpHдМЮЊ5ЁЃ | HSO3Ѓ НсКЯH+ ЕФФмСІБШSO32ЃЕФЧП |
D | ЗжБ№Яђ25mLРфЫЎКЭ25mLЗаЫЎжаЕЮШы6ЕЮFeCl3 БЅКЭШмвКЃЌЧАепЮЊЛЦЩЋЃЌКѓепЮЊКьКжЩЋЁЃ | ЮТЖШЩ§ИпЃЌFe3+ЕФЫЎНтГЬЖШдіДѓ |
A.AB.BC.CD.D
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊБНПЩвдНјааШчЯТзЊЛЏЃЌЛиД№ЯТСаЮЪЬтЃК
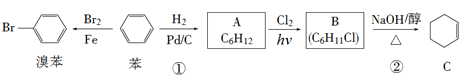
(1)ЗДгІЂйЕФЗДгІРраЭЮЊ________ЃЌЛЏКЯЮяAЕФЛЏбЇУћГЦЮЊ___________ЁЃ
(2)ЛЏКЯЮяBЕФНсЙЙМђЪНЮЊ_________ЃЌЗДгІЂкЕФЗДгІРраЭЮЊ__________ЁЃ
(3)аДГіЯТСаЗДгІЕФЛЏбЇЗНГЬЪН
AЁњBЃК_________________________ЁЃ
BЁњCЃК_________________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЕчНтжЪЫЎШмвКжаДцдкЕчРыЦНКтЁЂЫЎНтЦНКтЁЂШмНтЦНКтЃЌЧыЛиД№ЯТСаЮЪЬтЁЃ
Ђё. вбжЊВПЗжШѕЫсЕФЕчРыГЃЪ§ШчЯТБэЃК
ШѕЫс | HCOOH | HCN | H2CO3 |
ЕчРыГЃЪ§(25Ёц) | Ka= 1.77ЁС10-4 | Ka=4.3ЁСl0-10 | Ka1=5.0ЁСl0-7Ka2=5.6ЁСl0-11 |
ЃЈ1ЃЉ0.1 moI/L NaCNШмвККЭ0.1mol/L NaHCO3ШмвКжаЃЌcЃЈCNЃЃЉ______cЃЈHCO3 ЃЃЉЃЈЬюЁА>ЁБЁЂЁА<ЁБЛђЁА=ЁБЃЉЁЃ
ЃЈ2ЃЉГЃЮТЯТЃЌpHЯрЭЌЕФШ§жжШмвКAЃЎHCOONa BЃЎNaCN CЃЎNa2CO3ЃЌЦфЮяжЪЕФСПХЈЖШгЩДѓЕНаЁЕФЫГађЪЧ________ЃЈЬюБрКХЃЉЁЃ
ЃЈ3ЃЉЪвЮТЯТЃЌЁЊЖЈХЈЖШЕФHCOONaШмвКpH =9ЃЌгУРызгЗНГЬЪНБэЪОШмвКГЪМюадЕФдвђЪЧ___________ЁЃ
Ђђ. ЪвЮТЯТЃЌгУ0.100 mol/LбЮЫсШмвКЕЮЖЈ20.00mL0.l00mol/L ЕФФГАБЫЎШмвКЃЌЕЮЖЈЧњЯпШчЭМЫљЪОЁЃ

ЃЈ4ЃЉdЕуЫљЪОЕФШмвКжаРызгХЈЖШгЩДѓЕНаЁЕФЫГађвРДЮЮЊ_______________ЁЃ
ЃЈ5ЃЉbЕуЫљЪОЕФШмвКжаc(NH3ЁЄH2O) Ѓ c(NH4+)=______ЃЈгУШмвКжаЕФЦфЫќРызгХЈЖШБэЪОЃЉЁЃ
Ђѓ. вбжЊKsp(BaCO3) =2.6ЁСl0-9ЃЌKsp( BaSO4)=1.1ЁС10-10.
ЃЈ6ЃЉЯђКЌгаBaSO4ЙЬЬхЕФШмвКжаЕЮМгNa2CO3ШмвКЃЌЕБгаBaCO3ГСЕэЩњГЩЪБЃЌШмвКжа![]() =___________ЃЈБЃСєШ§ЮЛгааЇЪ§зжЃЉЁЃ
=___________ЃЈБЃСєШ§ЮЛгааЇЪ§зжЃЉЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЛЏКЯЮяMЪЧживЊЕФгаЛњКЯГЩжаМфЬх,HЮЊИпЗжзгЛЏКЯЮя,ЦфКЯГЩТЗЯпШчЭМЫљЪОЃК
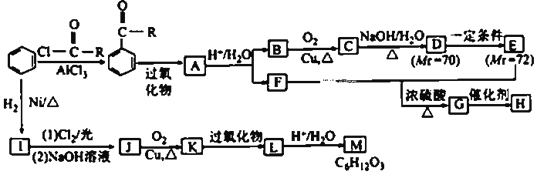
вбжЊЃКЂй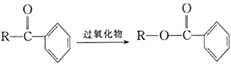 (RЮЊЬўЛљ);
(RЮЊЬўЛљ);
Ђк2R-CH2CHO![]()
![]() ЁЃ
ЁЃ
ЧыЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉEжаЫљКЌЙйФмЭХЕФУћГЦЮЊ____________ЁЃHЕФНсЙЙМђЪНЮЊ____________ЁЃ
ЃЈ2ЃЉCЁњDЩцМАЕФЗДгІРраЭга____________________________ЁЃ
ЃЈ3ЃЉAЁњB+FЕФЛЏбЇЗНГЬЪНЮЊ___________________________________ЁЃ
ЃЈ4ЃЉDгывјАБШмвКЗДгІЕФЛЏбЇЗНГЬЪНЮЊ___________ЁЃ
ЃЈ5ЃЉЗћКЯЯТСаЬѕМўЕФMЕФЭЌЗжвьЙЙЬхга____________жж(ВЛПМТЧСЂЬхвьЙЙ)ЁЃ
ЂйЙйФмЭХжжРрКЭЪ§ФПгыMЯрЭЌ
ЂкЗжзгжаКЌга1Иі-CH3КЭ1Иі-CH2CH2-
ЂлВЛКЌ-CH2CH2CH2-
ЃЈ6ЃЉЧыНсКЯЫљбЇжЊЪЖКЭЩЯЪіаХЯЂЃЌаДГівдБНМзШЉКЭвЛТШввЭщЮЊдСЯ(ЮоЛњЪдМСШЮбЁ)ЃЌжЦБИмаЛљввШЉ(![]() )ЕФКЯГЩТЗЯпЃК________________________ЁЃ
)ЕФКЯГЩТЗЯпЃК________________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com