
【题目】已知苯可以进行如下转化,回答下列问题:
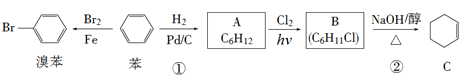
(1)反应①的反应类型为________,化合物A的化学名称为___________。
(2)化合物B的结构简式为_________,反应②的反应类型为__________。
(3)写出下列反应的化学方程式
A→B:_________________________。
B→C:_________________________。
【答案】加成反应 环己烷 ![]() 消去反应
消去反应 ![]()
![]()
【解析】
苯与液溴在Fe催化下发生取代反应产生溴苯![]() ,苯与H2在Pd/C催化下发生加成反应产生环己烷
,苯与H2在Pd/C催化下发生加成反应产生环己烷![]() ,环己烷与Cl2在光照条件下发生取代反应产生一氯环己烷
,环己烷与Cl2在光照条件下发生取代反应产生一氯环己烷![]() ,一氯环己烷与NaOH的乙醇溶液共热,发生消去反应产生环己烯
,一氯环己烷与NaOH的乙醇溶液共热,发生消去反应产生环己烯![]() 。
。
由上述分析可知A是![]() ,B是
,B是![]() 。
。
(1)反应①是![]() 与H2在Pd/C催化下发生加成反应产生环己烷
与H2在Pd/C催化下发生加成反应产生环己烷![]() ,反应类型为加成反应,化合物A是
,反应类型为加成反应,化合物A是![]() ,化学名称为环己烷。
,化学名称为环己烷。
(2)环己烷与Cl2在光照条件下发生取代反应产生化合物B是一氯环己烷,B的结构简式为![]() ,反应②是
,反应②是![]() 与NaOH的乙醇溶液共热,发生消去反应,产生
与NaOH的乙醇溶液共热,发生消去反应,产生![]() 、NaCl、H2O,该反应的反应类型为消去反应。
、NaCl、H2O,该反应的反应类型为消去反应。
(3)由(2)可知:A→B反应的化学方程式为:![]() 。B→C反应的化学方程式为:
。B→C反应的化学方程式为:![]() 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某种氢氧燃料电池的电解质溶液为KOH溶液,下列有关该电池的叙述错误的是( )
A.正极反应式为:O2+2H2O+4e-═4OH
B.工作一段时间后,电解液中KOH的物质的量浓度不变
C.该电池的总反应式为:2H2+O2═2H2O
D.当该电池生成9g水时,通过电路的电子为1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】软锰矿的主要成分是MnO2,还含有少量金属铁、镁、铝、锌、铜的化合物等杂质。黄铁矿的主要成分是FeS2,还含有硅、铝的氧化物等杂质。工业上用软锰矿制备碳酸锰并回收硫酸铵,其主要流程如下:

已知金属离子从开始形成氢氧化物沉淀,到沉淀时溶液的pH如下表:
金属离子 | Fe2+ | Fe3+ | Al3+ | Cu2+ | Mn2+ |
开始沉淀pH | 7.5 | 2.7 | 4.1 | 5.9 | 8.8 |
完全沉淀pH | 9.5 | 3.7 | 5.4 | 6.9 | 10.8 |
(1)提高浸出率的可采取的措施有____。
a.适当升高温度 b.搅拌 c.加适量纯碱 d.加压
(2)浸取完成后,取浸取液少许,加入KSCN溶液无明显现象,则浸取时发生的主要反应的化学方程式是__________________________。
(3)调节pH为5.4~5.8的目的是______________。
(4)滤渣3的主要成分的化学式是_______。
(5)采用50℃碳化的原因是_________________________________。该过程发生反应的离子方程式是__________________。
(6)检验碳酸锰产品完全洗净的方法是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别取1 molA、B、C、D、E、F六种有机物,使它们充分燃烧,都生成44.8LCO2(标况),D和E是碳、氢、氧的化合物,两者互为同分异构体,E被氧化成A,A继续氧化成B,C、F都能发生加聚反应,C和氯化氢加成生成F。试推断有机化合物A、B、C、D、E、F的结构简式。
(1)A.______、B.______、C.______、D.______、E.______、F.______。
(2)写出下列反应的化学方程式
E→A:_________________________________________。
实验室制备C:__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】数十年来,化学工作者对氮的氧化物、碳的氧化物做了广泛深入的研究并取得一些重要成果。
I.已知2NO(g)+O2(g) ![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
第一步:2NO(g) ![]() N2O2(g) (快) H1<0;v1正=k1正c2(NO) ;v1逆=k1逆c(N2O2)
N2O2(g) (快) H1<0;v1正=k1正c2(NO) ;v1逆=k1逆c(N2O2)
第二步:N2O2(g)+O2(g) ![]() 2NO2(g) (慢) H2< 0; v2正=k2正c(N2O2)c(O2);v2逆=k2逆c2(NO2)
2NO2(g) (慢) H2< 0; v2正=k2正c(N2O2)c(O2);v2逆=k2逆c2(NO2)
①2NO(g)+O2(g) ![]() 2NO2(g)的反应速率主要是由______(填“第一步”或“第二步”)反应决定。
2NO2(g)的反应速率主要是由______(填“第一步”或“第二步”)反应决定。
②一定温度下,反应2NO(g)+O2(g) ![]() 2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=____________;
2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=____________;
II.利用CO2和CH4重整不仅可以获得合成气(主要成分为CO、H2),还可减少温室气体的排放(1)已知重整过程中部分反应的热化方程式为:
① CH4(g)=C(s)+2H2(g) ΔH>0
② CO2(g)+H2(g)=CO(g)+H2O(g) ΔH>0
③ CO(g)+H2(g)=C(s)+H2O(g) ΔH<0
固定n(CO2)=n(CH4),改变反应温度,CO2和CH4的平衡转化率见图甲。
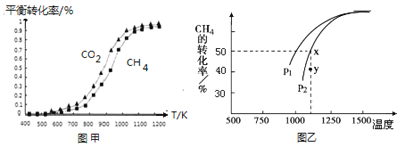
同温度下CO2的平衡转化率________(填“大于”“小于”或“等于”)CH4的平衡转化率。
(2)在密闭容器中通入物质的量均为0.1mol的CH4和CO2,在一定条件下发生反应CO2(g) + CH4(g) ![]() 2CO(g) + 2H2(g),CH4的平衡转化率与温度及压强(单位Pa)的关系如图乙所示。y点:v(正)_____v(逆)(填“大于”“小于”或“等于”)。已知气体分压(p分)=气体总压(p总)×气体的物质的量分数。用平衡分压代替平衡浓度可以得到平衡常数Kp,求x点对应温度下反应的平衡常数Kp=__________________。
2CO(g) + 2H2(g),CH4的平衡转化率与温度及压强(单位Pa)的关系如图乙所示。y点:v(正)_____v(逆)(填“大于”“小于”或“等于”)。已知气体分压(p分)=气体总压(p总)×气体的物质的量分数。用平衡分压代替平衡浓度可以得到平衡常数Kp,求x点对应温度下反应的平衡常数Kp=__________________。
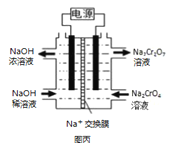
III.根据2CrO42﹣+2H+ ![]() Cr2O72﹣+H2O设计如图丙装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图丙中右侧电极连接电源的__极,电解制备过程的总反应方程式为__。测定阳极液中Na和Cr的含量,若Na与Cr的物质的量之比为a:b,则此时Na2CrO4的转化率为__。若选择用熔融K2CO3作介质的甲醇(CH3OH)燃料电池充当电源,则负极反应式为__。
Cr2O72﹣+H2O设计如图丙装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图丙中右侧电极连接电源的__极,电解制备过程的总反应方程式为__。测定阳极液中Na和Cr的含量,若Na与Cr的物质的量之比为a:b,则此时Na2CrO4的转化率为__。若选择用熔融K2CO3作介质的甲醇(CH3OH)燃料电池充当电源,则负极反应式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①:2C(s)+O2(g)═2CO(q)△H=﹣221.0kJ/mol②2H2(q)+O2(q)═2H2O(g)△H=﹣483.6kJ/mol,则制备水煤气的反应C(s)+H2O(g)═CO(g)+H2(g)的△H为( )
A.262.6kJ/mol B.﹣131.3kJ/mol C.﹣352.3kJ/mol D.+131.3kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】建构数学模型来研究化学问题,既直观又简洁,下列建构的数轴模型正确的是( )
A.钠在氧气中燃烧,钠的氧化产物:![]()
B.铁在Cl2中燃烧,铁的氧化产物:![]()
C.A1C13溶液中滴加NaOH溶液后体系中铝元素的存在形式:![]()
D.FeI2溶液中通入Cl2,铁元素存在形式:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置进行下列实验,能得出相应实验结论的是

选项 | ① | ② | ③ | 实验结论 |
A | 浓氨水 | NaOH | 酚酞试液 | 碱性:NaOH>NH3·H2O |
B | 浓硫酸 | 蔗糖 | 品红溶液 | 浓硫酸具有脱水性、氧化性 |
C | 稀盐酸 | Na2SO3 | Ba(NO3)2溶液 | SO2与可溶性钡盐反应均可生成白色沉淀 |
D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一种染料敏化太阳能电池的示意图,电池的一个电极由有机光敏染料(R)涂覆在TiO2纳米晶体表面制成,另一电极由导电玻璃镀铂构成,下列关于该电池叙述不正确的是( )

A.染料敏化TiO2电极为电池负极,发生氧化反应
B.正极电极反应式是:I3-+2e-=3I-
C.电池总反应是:2R++3I-=I3-+2R
D.电池工作时将太阳能转化为电能
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com