
����Ŀ����ˮAlCl3���������������л��ϳɵĴ����ȣ���ҵ����������Al2O3��Fe2O3��Ϊԭ���Ʊ���ˮAlCl3�Ĺ����������£�
��1���Ȼ�¯��Al2O3��Cl2��C��Ӧ�Ļ�ѧ����ʽΪ ��
��2����Na2SO3��Һ�ɳ�ȥ��ȴ���ų�β���е�Cl2 �� �˷�Ӧ�����ӷ���ʽΪ �� �ڱ�״���£�����112L Cl2��ҪmolNa2SO3 ��
��3��Ϊ�ⶨ�Ƶõ���ˮAlCl3��Ʒ��������FeCl3���Ĵ��ȣ���ȡ��ˮAlCl3��Ʒ�����ڹ�����NaOH��Һ�����˳��������ϴ�ӡ����ա���ȴ�����أ���д���ⶨ��ˮAlCl3��Ʒ���ȵĹ������йط�Ӧ�����ӷ���ʽ�� �� ��
��4����ҵ����һ��������Ϊԭ���Ʊ���ˮAlCl3�����У����һ������AlCl36H2O��ȥ�ᾧˮ�Ʊ���ˮAlCl3 �� ʵ����һ���IJ��������� ��
��5����ҵ���������ᴿ���ұ������д����950��970���Na3AlF6�����½��е��������Ӧ�Ļ�ѧ����ʽ ��
��6���������м���Al����һ���������� ��
���𰸡�
��1��A12O3+3Cl2+3C ![]() 2A1Cl3+3CO
2A1Cl3+3CO
��2��SO32��+C12+H2O=SO42��+2C1��+2H+��5
��3��Fe3++3OH��=Fe��OH��3����Al3++4OH��=AlO2��+2H2O
��4���ڸ���HCl�����м���
��5��2A12O3![]() 4Al+3O2��
4Al+3O2��
��6��������FeCl3��ԭΪFe
���������⣺��1�����ݹ������̿�֪�Ȼ�¯�IJ������ȴ���������Ʊ���ˮAlCl3 �� ˵���Ȼ�¯�IJ����к���A1C13 �� ������β������CO������Al2O3��C12��C��Ӧ������A1C13��CO����Ӧ����ʽΪA12O3+3C12+3C ![]() 2A1C13+3CO�� ���Դ��ǣ�A12O3+3C12+3C
2A1C13+3CO�� ���Դ��ǣ�A12O3+3C12+3C ![]() 2A1C13+3CO����2��Cl2��ǿ�����ԣ���SO32������ΪSO42�� �� ��������ԭΪ2C1�� �� ��Ӧ���ӷ���ʽΪSO32��+Cl2+H2O�TSO42��+2Cl��+2H+ �� �ڱ�״���£�112L Cl2�����ʵ���Ϊ5mol�����ɷ���ʽ��֪Ӧ����5molNa2SO3 ��
2A1C13+3CO����2��Cl2��ǿ�����ԣ���SO32������ΪSO42�� �� ��������ԭΪ2C1�� �� ��Ӧ���ӷ���ʽΪSO32��+Cl2+H2O�TSO42��+2Cl��+2H+ �� �ڱ�״���£�112L Cl2�����ʵ���Ϊ5mol�����ɷ���ʽ��֪Ӧ����5molNa2SO3 ��
���Դ��ǣ�SO32��+Cl2+H2O=SO42��+2Cl��+2H+��5����3�����ӹ����������������������ӽ�ϳ��������������������������������ӽ�ϳ�ƫ�������ˮ�����ӷ���ʽΪFe3++3OH��=Fe��OH��3����Al3++4OH��=AlO2��+2H2O��
���Դ��ǣ�Fe3++3OH��=Fe��OH��3����Al3++4OH��=AlO2��+2H2O����4���Ȼ�����Һ����ˮ�⣬��AlCl36H2O��ˮ�Ʊ���ˮ�Ȼ�������HCl�����м����ѽᾧˮ�����Դ��ǣ��ڸ���HCl�����м��ȣ���5����������950��970���Na3AlF6�����½��е��������������������ʽΪ2A12O3![]() 4Al+3O2����
4Al+3O2����
���Դ��ǣ�2A12O3![]() 4Al+3O2������6����������AlĿ���dz�ȥFeCl3 �� ������FeCl3��ԭΪFe�����Դ��ǣ�������FeCl3��ԭΪFe��
4Al+3O2������6����������AlĿ���dz�ȥFeCl3 �� ������FeCl3��ԭΪFe�����Դ��ǣ�������FeCl3��ԭΪFe��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���йش����ᴿ�ķ�����ȷ����
A.�ܽ����ʱ��Ӧ����ʹ��ҺϡһЩ������ʳ�β��ܽ�
B.���Ƶõľ���ת�Ƶ����ƹ������У��ô���ˮ����ϴ��
C.������������������ȫ���ᾧ�����ſ�ֹͣ����
D.��ȥ���������ʺ���Һ�����������ڼ���Ũ�������Ͻ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ͨ�����Ϸ�Ӧֱ���Ƶõ��ǣ� ��
��FeCl2��H2SO4��NH4NO3��HCl ��FeCl3 ��
A.ֻ�Т٢ڢ�
B.ֻ�Тܢ�
C.ֻ�Т٢ۢ�
D.ȫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڷ�Ӧ�����������仯��˵����ȷ���ǣ� ��
A.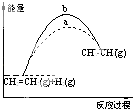 ͼ��a��b���߿ɷֱ��ʾ��ӦCH2=CH2��g��+H2��g����CH3CH3��g����H��0ʹ�ú�δʹ�ô���ʱ����Ӧ�����е������仯
ͼ��a��b���߿ɷֱ��ʾ��ӦCH2=CH2��g��+H2��g����CH3CH3��g����H��0ʹ�ú�δʹ�ô���ʱ����Ӧ�����е������仯
B.��֪2C��s��+2O2��g��=2CO2��g����H1��2C��s��+O2��g��=2CO��g����H2 �� ���H1����H2
C.ͬ��ͬѹ�£���ӦH2��g��+Cl2��g��=2HCl��g���ڹ��պ͵�ȼ�����µġ�H��ͬ
D.��һ�������£�ij���淴Ӧ�ġ�H=+100kJmol��1 �� ��÷�Ӧ����Ӧ��ܱ��淴Ӧ��ܴ�100kJmol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ǹ�ҵ�������ճ������е���Ҫ���ʣ�ij��ȤС��Ϊ�ⶨij��ҵ����������̼���������ʣ���̼���Ƶ������������������������ʵ�鷽������̽��������գ�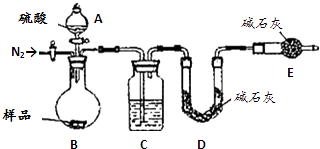
����һ��������Ʒ ![]() �ⶨʣ���������
�ⶨʣ���������
��1���ֱ��ȡ���������ʹ�����Ʒ����������������Ʒ���������г�ּ��ȣ������з�����Ӧ�Ļ�ѧ����ʽΪ�� ��
��2�����������ڸ���������ȴ�������ʵ��ʱ��Ҫ�ظ������ȡ���ȴ��������������Σ���Ŀ���ǣ� �� ����������ȡmg��Ʒ���250mL��Һ������ȡ25mL��Һ���÷�̪��ָʾ����0.1molL��1HCl��Һ�ζ����յ㣬����0.1molL��1HCl��ҺV1mL�������ü�����ָʾ���ζ����յ㣬����0.1molL��1HCl��ҺV2mL�������Ʒ��̼���Ƶ���������Ϊ�� ��
��������������Ʒ��Һ ![]() �ⶨ��������
�ⶨ��������
��3����ȡm1g��Ʒ������С�ձ��У���ˮ�ܽ⣮��С�ձ��еμ������Ȼ�����Һ������Ӧ�������˺����һ�������ǣ� �� ��������������Ϊm2g��
��4�����������������Һ�����Ȼ�����Һ����������������������ȷ������£������Ʒ�е�̼����������������ʵ�����ƫ�ߡ�����ƫ�͡����䡱���������ģ�������Ʒ ![]() �ⶨ���ɶ�����̼������
�ⶨ���ɶ�����̼������
��5����ʵ���������ͼװ�ã�C��ʢ�ŵ������� ��
��6����Ӧǰ��Ҫͨ��N2 �� ��Ӧ��ͨ��N2��Ŀ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���в���ȷ���ǣ� ��
A.�縺�ԵĴ�С˳��ΪCl��S��P
B.����NO3����SO3��Ϊ�ȵ����壬���Կ����ƶ�NO3���Ŀռ乹��Ϊƽ��������
C.���ݾ����ܵĴ�С�����ж�MgCl2���۵��CaCl2��
D.Һ̬HF�ķе��Һ̬HCl�ķе������Ϊ������ļ��ܱ����ȼ��ļ��ܴ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯���������������ϵ���С������������գ�
��1��ijѧУ��ѧѧϰС��Ϊ̽���������������ʣ�����ͼ��ʾװ�ý���ʵ�顣

��װ�ü���ʢ��Ũ���������A��������__________________�� װ�ñ��е��Թ��ڷ�����Ӧ�����ӷ���ʽΪ��______________________________��
��ʵ�������װ���ҡ����г��ֵ�����ֱ���________________________��______________��
��2��NO��ҽ��������Ҫ��Ӧ�ã�������ѧ����Ϊ�о�����Ҫ���ʡ������ݻ�ΪaL���Թ�ʢ��NO����ˮ���У������Թ���ͨ��һ�����O2���Թ�����������Ϊ�Թ��ݻ���һ�룬��ͨ���O2������ͬ���������Ϊ____________��
A.0.75aL B.0.375aL C.0.625aL D.1.25aL
��3����ʢ��һ����Ũ������Թ��м���12.8g��ͭƬ������Ӧ����ش��������⣺
�ٿ�ʼ��,��Ӧ�Ļ�ѧ����ʽΪ_______________________________����һ�����ɵ�����Ϊ
_______,������ǡ����ȫ��Ӧ������Ӧ���̹�������״��������2.24L����Ӧ�����б���ԭ��HNO3�����ʵ���Ϊ__________ mol.,�μӷ�Ӧ��HNO3�����ʵ���Ϊ__________ mol.��
�ڷ�Ӧ���������Թ��м���ͭƬ���ټ�������20%��ϡ���ᣬ��ʱͭƬ���������ݲ�������Ӧ�����ӷ���ʽΪ____________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڱ���ϩ�����������У���ȷ���ǣ� �� ����ʹ����KMnO4��Һ��ɫ��
�ڿɷ����ӳɷ�Ӧ��
�ۿ�����ˮ��
�ܿ����ڱ��У�
������Ũ������ŨH2SO4�����·���ȡ����Ӧ��
�����е�ԭ�ӿ��ܹ�ƽ�森
A.�٢ڢۢܢ�
B.�٢ڢݢ�
C.�٢ڢܢݢ�
D.ȫ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com