
【题目】电解质溶液的电导率越大,导电能力越强。用![]() 的NaOH溶液滴定
的NaOH溶液滴定![]() 浓度均为
浓度均为![]() 的
的![]() 和
和![]() 溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是
溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是![]()
![]()
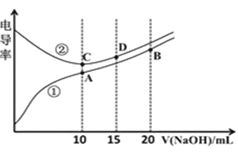
A.C点溶液呈酸性,A点溶液呈碱性
B.A点溶液中:![]()
C.在相同温度下,A、B、C三点溶液中水的电离程度:![]()
D.D点溶液中:![]()
【答案】D
【解析】
溶液的导电能力与离子浓度成正比,由导电率图像可知,HX是弱酸,其溶液中离子浓度较小,加入NaOH溶液后,溶液中离子浓度增大,溶液导电性增强;HY比HX的酸性强,HY可能是强酸或者是比HX的酸性强的弱酸,随着NaOH溶液的加入,溶液体积的增大,溶液中离子浓度减小,溶液导电能力减弱,当HY与所加NaOH恰好完全反应时离子浓度最小,继续加入NaOH溶液,离子浓度增大,溶液导电能力增强。
A.由以上分析可知,C点溶液中溶质为NaY,溶液呈中性或者碱性,A点溶液呈碱性,故A错误;
B.A点时,HX与NaOH恰好完全中和,生成强碱弱酸盐,溶液显碱性,则![]() ,故B错误;
,故B错误;
C.酸或碱抑制水的电离,能水解的盐促进水的电离,C点溶液中溶质为NaY,A点溶液中溶质为NaX,由于HY的酸性大于HX,故![]() 的水解程度小于
的水解程度小于![]() ,则NaX促进水的电离程度大于NaY,B点溶液为等浓度的NaX和NaOH的混合溶液,NaOH会抑制水的电离,所以在相同温度下,水的电离程度:
,则NaX促进水的电离程度大于NaY,B点溶液为等浓度的NaX和NaOH的混合溶液,NaOH会抑制水的电离,所以在相同温度下,水的电离程度:![]() ,故C错误;
,故C错误;
D.D点溶液为含![]() 和
和![]() 的混合溶液,由电荷守恒知,D点溶液中存在:
的混合溶液,由电荷守恒知,D点溶液中存在:![]() ,又
,又![]() ,则
,则![]() ,故
,故![]() ,D正确。
,D正确。
故选D。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.乳酸薄荷醇酯 ![]() 仅能发生水解、氧化、消去反应
仅能发生水解、氧化、消去反应
B.乙醛和丙烯醛![]() 不是同系物,但它们与氢气充分反应后的产物是同系物
不是同系物,但它们与氢气充分反应后的产物是同系物
C.甲醇、乙醇、乙二醇的沸点逐渐升高
D.甲苯、乙烯均能使酸性 KMnO4 溶液褪色,但反应原理不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,关于pH相同的氨水和氢氧化钠溶液,下列说法正确的是( )
A.c(NaOH)>c(NH3·H2O)
B.c(![]() )=c(Na+)=c(OH-)
)=c(Na+)=c(OH-)
C.两种溶液中水的电离程度相同
D.等体积的氨水和氢氧化钠溶液分别与相同浓度的盐酸完全中和时,消耗的盐酸体积相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,下列溶液中,离子浓度关系正确的是
时,下列溶液中,离子浓度关系正确的是![]()
A.![]() 的氨水稀释10倍后,其
的氨水稀释10倍后,其![]() ,则
,则![]()
B.浓度相同的![]() ,三种溶液中的
,三种溶液中的![]()
C.将相同浓度的氨水与盐酸等体积混合,所得溶液中的离子浓度关系:![]()
D.将![]() 与
与![]() 溶液等体积混合,测得溶液pH为7,则a与b的关系:
溶液等体积混合,测得溶液pH为7,则a与b的关系:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光刻技术需利用深紫外激光,我国是唯一掌握通过非线性光学晶体变频来获得深紫外激光技术的国家。目前唯一实用化的晶体是氟硼铍酸钾(KBeBF,含K、B、Be、O、F元素)。
回答下列问题:
(1)一群均处于激发态1s22s13s1的铍原子,若都回到基态,最多可发出___种波长不同的光。
A.1 B.2 C.3 D.4
(2)Be和B都容易与配体形成配位键,如[BeF4]-、[B(OH)4]-等,从原子结构分析其原因是__。
(3)氟硼酸钾是制备KBeBF的原料之一,高温下分解为KF和BF3。KF的沸点比BF3的高,原因是___。
(4)BF3易水解得到H3BO3(硼酸)和氢氟酸。氢氟酸浓溶液中因F-与HF结合形成HF![]() 使酸性大大增强。HF
使酸性大大增强。HF![]() 的结构式为___;H3BO3和BF
的结构式为___;H3BO3和BF![]() 中,B原子的杂化类型分别为___、__。
中,B原子的杂化类型分别为___、__。
(5)KBeBF晶体为层片状结构,图1为其中一层的局部示意图。平面六元环以B—O键和Be—O键交织相连,形成平面网状结构,每个Be都连接一个F,且F分别指向平面的上方或下方,K+分布在层间。KBeBF晶体的化学式为____。

(6)BeO晶体也是制备KBeBF的原料,图2为其晶胞结构示意图。
①沿着晶胞体对角线方向的投影,下列图中能正确描述投影结果的是___。

②BeO晶胞中,O的堆积方式为____;设O与Be的最近距离为acm,NA表示阿伏加德罗常数的值,则BeO晶体的密度为____g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁、铝、硅、银、铁的单质及其化合物在建筑业、飞机制造业、电子工业和石油化工等方面应用广泛。回答下列问题:
(1)Fe3+价层电子的轨道表达式(电子排布图)为__。
(2)晶体硅属于______晶体。硅能形成多种化合物(如SiH4、Si2H4等),SiH4的分子的立体构型为____;Si2H4分子中含有的σ键和π键的数目之比为____。
有机物种类繁多的原因其中之一就是因为碳原子之间既可以形成单键又可以形成双键和三键,Si和Ge与C是同主族价电子数相同,但是Si和Ge就难形成双键或三键,原因是________
(3)Mg、Al、Si的第一电离能由大到小顺序:______________
(4)Ca和Fe属于同一周期,且核外最外层电子构型相同,但金属Ca的熔点、沸点等都比金属Fe低,原因是______。
(5)Ag晶体的堆积方式为面心立方最密堆积(如图所示),晶胞中Ag原子的配位数为______;设Ag原子半径为rcm,阿伏加德罗常数的值用NA表示,则Ag晶体的密度为______g·cm-3(写出表达式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在药物制剂中,抗氧剂与被保护的药物在与![]() 发生反应时具有竞争性,抗氧性强弱主要取决于其氧化反应的速率。
发生反应时具有竞争性,抗氧性强弱主要取决于其氧化反应的速率。![]() 、
、![]() 和
和![]() 是三种常用的抗氧剂。已知:
是三种常用的抗氧剂。已知:![]() 溶于水发生反应:
溶于水发生反应:![]() ;
;![]() 以原溶液和一定量的酸或碱混合,保持总体积不变的方式调节pH。
以原溶液和一定量的酸或碱混合,保持总体积不变的方式调节pH。
实验用品 | 实验操作和现象 |
| 实验1:溶液 |
| 实验2:溶液
|
| 实验3:调溶液 |
下列说法中不正确的是 ![]()
A.![]() 溶液显碱性,原因是
溶液显碱性,原因是![]()
B.![]() 溶液中
溶液中![]() 的电离程度大于水解程度
的电离程度大于水解程度
C.实验2说明,![]() 在
在![]() 时抗氧性最强
时抗氧性最强
D.实验3中,三种溶液在pH相同时起抗氧作用的微粒种类和浓度相同,因此反应速率相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C1O2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得C1O2:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法中正确的是
2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法中正确的是
A. 在反应中H2C2O4既不是氧化剂也不是还原剂
B. 1 mol KClO3参加反应,在标准状况下能得到22.4 L气体
C. 1 mol KClO3参加反应有2 mol电子转移
D. KClO3在反应中是氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述不相符的是( )
A.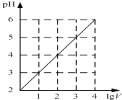
表示1![]() 的
的![]() 溶液加水稀释至VL,pH随lgV的变化
溶液加水稀释至VL,pH随lgV的变化
B.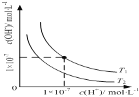
表示不同温度下水溶液中![]() 和
和![]() 浓度的变化的曲线,图中温度
浓度的变化的曲线,图中温度![]()
C.
表示一定条件下的合成氨反应中,![]() 的平衡体积分数随
的平衡体积分数随![]() 起始体积分数
起始体积分数![]() 的起始量恒定
的起始量恒定![]() 的变化,图中a点
的变化,图中a点![]() 的转化率小于b点
的转化率小于b点
D.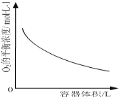
表示同一温度下,在不同容积的容器中进行反应![]() ,
,![]() 的平衡浓度与容器容积的关系
的平衡浓度与容器容积的关系
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com