
【题目】镁、铝、硅、银、铁的单质及其化合物在建筑业、飞机制造业、电子工业和石油化工等方面应用广泛。回答下列问题:
(1)Fe3+价层电子的轨道表达式(电子排布图)为__。
(2)晶体硅属于______晶体。硅能形成多种化合物(如SiH4、Si2H4等),SiH4的分子的立体构型为____;Si2H4分子中含有的σ键和π键的数目之比为____。
有机物种类繁多的原因其中之一就是因为碳原子之间既可以形成单键又可以形成双键和三键,Si和Ge与C是同主族价电子数相同,但是Si和Ge就难形成双键或三键,原因是________
(3)Mg、Al、Si的第一电离能由大到小顺序:______________
(4)Ca和Fe属于同一周期,且核外最外层电子构型相同,但金属Ca的熔点、沸点等都比金属Fe低,原因是______。
(5)Ag晶体的堆积方式为面心立方最密堆积(如图所示),晶胞中Ag原子的配位数为______;设Ag原子半径为rcm,阿伏加德罗常数的值用NA表示,则Ag晶体的密度为______g·cm-3(写出表达式)。

【答案】![]() 原子 正四面体形 5:1 Si、Ge原子半径大,原子间形成σ键长,P-P轨道几乎不能重叠,难以形成稳定的π键,所以不易形成双键或三键 Si>Mg>Al Ca的原子半径较大,且价电子较少,金属键较弱 12
原子 正四面体形 5:1 Si、Ge原子半径大,原子间形成σ键长,P-P轨道几乎不能重叠,难以形成稳定的π键,所以不易形成双键或三键 Si>Mg>Al Ca的原子半径较大,且价电子较少,金属键较弱 12 ![]()
【解析】
根据Fe核电荷数为26,核外26个电子,Fe3+则失去最外层4s上2个电子和3d轨道上一个电子,写出价电子的轨道表达式;根据Si晶体的结构推出晶体类型,由VSEPR理论确定SiH4的空间构型,由C2H4结构类推Si2H4中σ键、π键,由Si、Ge原子半径大,原子间形成σ键长,P-P轨道不能重叠,说明难形成双键或叁键;根据第一电离能递变规律,判断电离能的大小;根据Ca的原子半径比Fe大,形成金属键弱来解释;根据晶体的结构,进行晶胞的相关计算。
(1)Fe元素为26号元素,原子核外有26个电子,所以核外电子排布式为:1s22s22p63s23p63d64s2或[Ar]3d64s2,Fe3+的价层电子为其3d能级上5个电子,Fe3+的价层电子的电子排布图为:![]() ;答案为:
;答案为:![]() 。
。
(2)晶体硅是Si原子间通过共价键形成的网状立体结构,属于原子晶体,SiH4的中心原子的价层电子对数=4+![]() (41×4)=4,没有孤电子对,故中心原子的杂化轨道类型为sp3杂化,其分子的立体构型为正四面体,键角109°28',Si2H4分子与乙烯一致,Si原子成2个Si-H键、1个Si=Si键,单键是σ键,双键中含有1个σ键、1个π键,故分子中含有5个σ键、1个π键,1molSi2H4分子中含有σ键与π键的数目之比为5:1,因为Si、Ge原子半径大,原子间形成σ键长,P-P轨道几乎不能重叠,难以形成稳定的π键,所以不易形成双键或三键,答案为原子,正四面体,5:1,因为Si、Ge原子半径大,原子间形成σ键长,P-P轨道几乎不能重叠,难以形成稳定的π键,所以不易形成双键或三键。
(41×4)=4,没有孤电子对,故中心原子的杂化轨道类型为sp3杂化,其分子的立体构型为正四面体,键角109°28',Si2H4分子与乙烯一致,Si原子成2个Si-H键、1个Si=Si键,单键是σ键,双键中含有1个σ键、1个π键,故分子中含有5个σ键、1个π键,1molSi2H4分子中含有σ键与π键的数目之比为5:1,因为Si、Ge原子半径大,原子间形成σ键长,P-P轨道几乎不能重叠,难以形成稳定的π键,所以不易形成双键或三键,答案为原子,正四面体,5:1,因为Si、Ge原子半径大,原子间形成σ键长,P-P轨道几乎不能重叠,难以形成稳定的π键,所以不易形成双键或三键。
(3)同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,Mg、Al、Si为同一周期元素,镁为IIA族元素,所以元素第一电离能:Si>Mg>Al;答案为Si>Mg>Al。
(4)与Fe相比Ca的原子半径较大,且价电子较少,金属键较弱,则金属Ca的熔点、沸点等都比金属Fe低;答案为金属Ca的原子半径较大,且价电子较少,金属键较弱。
(5)由晶胞图可知,Ag为面心立方最密堆积,以顶点Ag原子研究,其配原子位于晶胞面心,每个顶点为8个晶胞共用,每个面心为2个晶胞共用,故其配原子数目为![]() =12,处于面对角线上的原子相邻,Ag原子半径为r cm,则晶胞棱长为2
=12,处于面对角线上的原子相邻,Ag原子半径为r cm,则晶胞棱长为2![]() rcm,晶胞中Ag原子数目=8×
rcm,晶胞中Ag原子数目=8×![]() +6×
+6×![]() =4,晶胞质量=4×
=4,晶胞质量=4×![]() g,晶体密度=(4×
g,晶体密度=(4×![]() g)÷(2
g)÷(2![]() rcm)3=
rcm)3=![]() gcm-3;答案为:12,
gcm-3;答案为:12,![]() 。
。


科目:高中化学 来源: 题型:
【题目】普伐他汀是一种调节血脂的药物,其结构如图所示。下列关于普伐他汀的性质描述正确的是
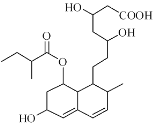
A.能发生加成、取代、消去反应
B.不能使酸性KMnO4溶液褪色
C.能与FeCl3溶液发生显色反应
D.1mol该物质最多可与3molNaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏伽德罗常数的值。关于常温下pH=2的H2SO4溶液,溶液中不存在H2SO4分子,但存在HSO4一离子,下列说法错误的是
A.每升溶液中的H+数目为0.01NA
B.Na2SO4溶液中:c(Na+)=2c(SO42-)>c(H+)=2c(OH-)
C.向稀硫酸中逐滴滴加浓硫酸,溶液中![]() 减小
减小
D.NaHSO4不是弱电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2SO3、NaHSO3、Na2S2O5可用于食品工业的漂白剂、防腐剂、抗氧化剂。已知:1molL﹣1Na2SO3溶液的pH≈9;1molL﹣1NaHSO3溶液的pH≈5。
(1)NaHSO3溶液的pH≈5的原因是_______(用化学用语并结合文字说明回答)。
(2)甲同学结合微粒观,应用所学知识,设计了如图所示实验,发现闭合开关后灵敏电流计指针发生偏转。

则:
①a电极为_______(填“正极”或“负极”);电极反应式为:______________。
②取少量Na2SO3溶液电极附近的混合液,加入_______,产生白色沉淀,证明产生了![]() 。
。
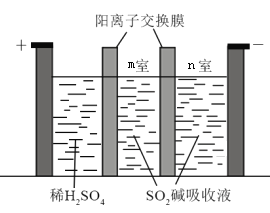
(3)制备Na2S2O5也可采用三室膜电解技术,装置如图所示,其中SO2碱吸收液中含有NaHSO3和Na2SO3,则阳极的电极反应式为_____________。电解后,_____________室的NaHSO3浓度增加。
(4)乙同学测定市面上某干红葡萄酒中Na2S2O5残留量,取50.00 mL葡萄酒样品于锥形瓶中,用装有0.010 mol·L1碘标准液的_________(填“酸式”或“碱式”)滴定管滴定至终点,消耗标准液10.00 mL。该样品中Na2S2O5的残留量为____________g·L1(以SO2计)。(已知:![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液的电导率越大,导电能力越强。用![]() 的NaOH溶液滴定
的NaOH溶液滴定![]() 浓度均为
浓度均为![]() 的
的![]() 和
和![]() 溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是
溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是![]()
![]()
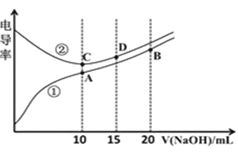
A.C点溶液呈酸性,A点溶液呈碱性
B.A点溶液中:![]()
C.在相同温度下,A、B、C三点溶液中水的电离程度:![]()
D.D点溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前工业上利用甲烷催化裂解生产不含一氧化碳和二氧化碳的清洁氢气。该过程多用铁、钴和镍等过渡金属纳米催化剂:CH4(g)![]() C(s)+2H2(g),已知温度升高,甲烷的平衡转化率增大。下列有关说法不正确的是( )
C(s)+2H2(g),已知温度升高,甲烷的平衡转化率增大。下列有关说法不正确的是( )
A.甲烷裂解属于吸热反应
B.在反应体系中加催化剂,反应速率增大
C.增大体系压强,不能提高甲烷的转化率
D.在1500℃以上时,甲烷的转化率很高,但几乎得不到炭黑,是因为在高温下该反应为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以镍黄铁矿为原料制备![]() 的工艺流程如下:
的工艺流程如下:
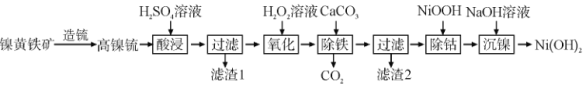
已知:①高镍锍的主要成分为![]() 、
、![]() 、
、![]() 、
、![]() 的低价硫化物及合金;
的低价硫化物及合金;
②氧化性:![]() ;
;
③![]() ,
,![]() ,
,![]() 。
。
回答下列问题:
(1)“酸浸”时,![]() 溶液需过量,其目的是________。
溶液需过量,其目的是________。
(2)“氧化”时反应的化学方程式为________,若用![]() 代替
代替![]() 溶液,使
溶液,使![]() 转化为
转化为![]() ,则需
,则需![]() 至少为________
至少为________![]() 。
。
(3)“除铁”的原理是________。
(4)“过滤”时滤渣1的主要成分是________。
(5)“沉镍”后需过滤、洗涤,证明沉淀已洗涤干净的方法是________________。若“沉镍”后的滤液中![]() ,则滤液的
,则滤液的![]() ________。
________。
(6)“除钴”时,发生反应的离子方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用如下装置制备乙酸乙酯。下列有关分析不正确的是

A. b中导管不能插入液面下,否则会阻碍产物的导出
B. 固体酒精是一种白色凝胶状纯净物,常用于餐馆或野外就餐
C. 乙酸乙酯与![]() 互为同分异构体
互为同分异构体
D. 乙酸、水、乙醇羟基氢的活泼性依次减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.PM2.5是指大气中直径≤2.5×10-6 m的颗粒物,则受PM2.5污染的大气定能产生丁达尔效应
B.根据电解质在水溶液中电离的程度,将电解质分为强电解质和弱电解质
C.黑火药的配方为“一硫二硝三木炭”,其中“硝”是指硝酸
D.![]() 、
、![]() 是制造氢弹的原料,它们是同一种核素
是制造氢弹的原料,它们是同一种核素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com