
����Ŀ��Na2SO3��NaHSO3��Na2S2O5������ʳƷ��ҵ��Ư������������������������֪��1molL��1Na2SO3��Һ��pH��9��1molL��1NaHSO3��Һ��pH��5��
(1)NaHSO3��Һ��pH��5��ԭ����_______(�û�ѧ���ﲢ�������˵���ش�)��
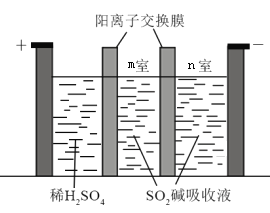
(2)��ͬѧ������ۣ�Ӧ����ѧ֪ʶ���������ͼ��ʾʵ�飬���ֱպϿ��غ�����������ָ�뷢��ƫת��

��
��a�缫Ϊ_______(��������������������)���缫��ӦʽΪ��______________��
��ȡ����Na2SO3��Һ�缫�����Ļ��Һ������_______��������ɫ������֤��������![]() ��
��
(3)�Ʊ�Na2S2O5Ҳ�ɲ�������Ĥ��⼼����װ����ͼ��ʾ������SO2������Һ�к���NaHSO3��Na2SO3���������ĵ缫��ӦʽΪ_____________������_____________�ҵ�NaHSO3Ũ�����ӡ�
(4)��ͬѧ�ⶨ������ij�ɺ����Ѿ���Na2S2O5��������ȡ50.00 mL���Ѿ���Ʒ����ƿ�У���װ��0.010 mol��L1���Һ��_________(������ʽ��������ʽ��)�ζ��ܵζ����յ㣬���ı�Һ10.00 mL������Ʒ��Na2S2O5�IJ�����Ϊ____________g��L1(��SO2��)��(��֪��![]() )
)
���𰸡�NaHSO3��Һ����![]() H++
H++![]() �ĵ���ƽ���
�ĵ���ƽ���![]() +H2OH2SO3+OH-��ˮ��ƽ�⣬����ƽ�����ˮ��ƽ��������� ���� Fe3++e-=Fe2+ ���������BaCl2��Һ 2H2O��4e��=4H++O2�� m ��ʽ 0.128
+H2OH2SO3+OH-��ˮ��ƽ�⣬����ƽ�����ˮ��ƽ��������� ���� Fe3++e-=Fe2+ ���������BaCl2��Һ 2H2O��4e��=4H++O2�� m ��ʽ 0.128
��������
���������Ϣ���Ƚϵ���ˮ��̶ȷ���1molL��1NaHSO3��Һ��pH��5��ԭ����ԭ��غ͵��ع���ԭ���жϵ缫����д�缫��Ӧʽ�����ݻ�ѧ��Ӧ����ʽ�ù�ϵʽ������ؼ��㡣
(1)NaHSO3��Һ��![]() ͬʱ���ڵ���ƽ���ˮ��ƽ�⣺
ͬʱ���ڵ���ƽ���ˮ��ƽ�⣺![]() H++
H++![]() ��
��![]() +H2OH2SO3+OH-���ҵ���̶ȴ���ˮ��̶ȣ��������ԣ�
+H2OH2SO3+OH-���ҵ���̶ȴ���ˮ��̶ȣ��������ԣ�
(2)ָ�뷢��ƫת��˵��������ԭ��أ�a�缫��Һ��Fe3+���������ԣ��õ��ӣ�aΪ�������缫��ӦʽΪ![]() ��b�缫��Һ��
��b�缫��Һ��![]() ���л�ԭ�ԣ�ʧ���ӣ�bΪ�������缫��ӦʽΪ
���л�ԭ�ԣ�ʧ���ӣ�bΪ�������缫��ӦʽΪ![]() ������
������![]() ѡ�����������BaCl2��Һ��
ѡ�����������BaCl2��Һ��
(3)����������ʧ���ӷ���������Ӧ����������ϡ![]() ��OH-�ŵ磬�缫��ӦʽΪ2H2O��4e��=4H++O2����������H+���࣬ͨ�������ӽ���Ĥ����m�ң���Na2SO3��Ӧ����NaHSO3��m��NaHSO3���ӣ�����H+�ŵ磬OH-���࣬��NaHSO3��Ӧ����Na2SO3��n��NaHSO3���٣�
��OH-�ŵ磬�缫��ӦʽΪ2H2O��4e��=4H++O2����������H+���࣬ͨ�������ӽ���Ĥ����m�ң���Na2SO3��Ӧ����NaHSO3��m��NaHSO3���ӣ�����H+�ŵ磬OH-���࣬��NaHSO3��Ӧ����Na2SO3��n��NaHSO3���٣�
(4)![]() ��
��![]() ���������ԣ�Ӧ����ʽ�ζ��ܵμӣ����ĵ�
���������ԣ�Ӧ����ʽ�ζ��ܵμӣ����ĵ�![]() ����
����![]() ������Ϊ
������Ϊ![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ�о���ѧϰС��̽����ͭ�йص����ʵ����ʣ�����������£�
������룺
����1����Ԫ�����ڱ��У�ͭ������λ�úܽӽ������������������ԣ�������ͭ��������
����2������ͭ���б�ۣ�һ������£�Fe2+���ȶ������ڵ�Fe3+��Cu+���ȶ���Ҳ����Cu2+��
����3������ͭ��Һ����ɫ��ͭ��Ũ���᳣���·�Ӧ���ɵ���ҺҲ����ɫ��
ʵ��̽����
��.�������1��
��1��ʵ��������100mL0.50molL-1CuSO4��Һ������IJ��������н�ͷ�ιܡ��ձ���___��___��
��2��Ϊ�ﵽĿ�ģ�ijͬѧ��ΪֻҪ��������ʵ�鼴�ɵó����ۡ���д��ʵ��ڵľ������ݡ�
����ʢ��CuSO4��Һ���Թ��еμ�NaOH��Һ���������۲����ɵ�Cu(OH)2�����Ƿ��ܽ⣻
��___��
��.�������2��ʵ����������£�
��ȡһ�����Ƶõ�������ͭ���壬�����������գ����¶ȴﵽ80��100��ʱ�õ���ɫ�����ĩ������������1000�����ϣ���ɫ��ĩȫ����ɺ�ɫ��ĩ������ͭ��
��ȡ������ɫ������ͭ��ĩ�ڽྻ�Թ��У����������ϡ���ᣬ�õ���ɫ��Һ��ͬʱ�۲쵽�Թܵײ����к�ɫ������ڡ���������ʵ�鼰����ش��������⣺
��3��д��������ͭ��ϡ���ᷴӦ�����ӷ���ʽ��___��
��4����ʵ���пɵó��Ľ��ۣ����¶���1000������ʱ___(��Cu2+��Cu+����ͬ)�ȶ�����������Һ��___�ȶ���
��.�������3��ijͬѧ��Ƶ�ʵ�����£�
ȡһͭƬװ���Թܣ�����������Ũ���ᣬ�۲���Һ����ɫ�仯��
��5����һͬѧ��Ϊ��ͬѧ��Ƶ�ʵ����ȱ�ݣ�ԭ����___��
��6��ͭ��Ũ���ᷴӦ��Һ����ɫ����ͬѧ��Ϊ�������ɵ�NO2�������е�ԭ�������ʵ��˵���˽����Ƿ���ȷ(ֻ��Ҫд��һ�ַ�������)��___
ʵ�鲽�� | ʵ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڹ�ҵ������˵���У�����ȷ����
A. ��ҵ�ϣ��ý�̿�ڵ�¯�л�ԭ��������õ����������ʵĴֹ�
B. �ȼҵ�����õĽ���ĤΪ�����ӽ���Ĥ����������ͨ������ֹ��������Ӧ����������Ʋ�����
C. ������ͨ��������Ҫԭ����ʯ��ʯ��ʯӢ�ʹ���
D. �ڸ�¯�����ķ�Ӧ�У���̿Ϊ����ʯ�Ļ�ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ӧ4A(s)��3B(g)��2C(g)��D(g)����2 min��B��Ũ�ȼ�����0.6mol/L�����з�Ӧ���ʵı�ʾ��ȷ����
A. ��A��ʾ�ķ�Ӧ������0.4 mol/(L��min)
B. ��C��ʾ�ķ�Ӧ������0.2 mol/(L��min)
C. 2 minĩʱ�ķ�Ӧ���ʣ���B��ʾ��0.3 mol/(L��min)
D. ����2 min����B��ʾ�ķ�Ӧ���ʵ�ֵ�Ǽ�С�ģ�C��ʾ�ķ�Ӧ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��![]() ʱ��������Һ�У�����Ũ�ȹ�ϵ��ȷ����
ʱ��������Һ�У�����Ũ�ȹ�ϵ��ȷ����![]()
A.![]() �İ�ˮϡ��10������
�İ�ˮϡ��10������![]() ����
����![]()
B.Ũ����ͬ��![]() ��������Һ�е�
��������Һ�е�![]()
C.����ͬŨ�ȵİ�ˮ������������ϣ�������Һ�е�����Ũ�ȹ�ϵ��![]()
D.��![]() ��
��![]() ��Һ�������ϣ������ҺpHΪ7����a��b�Ĺ�ϵ��
��Һ�������ϣ������ҺpHΪ7����a��b�Ĺ�ϵ��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£��ֱ���0.1mol/L��Һ��������ʵ�飬��������ȷ����![]()
![]()
A.��![]() ��Һ��ͨ
��Һ��ͨ![]() ��
��![]() ��c(Na+)��c(HCO3-)+ 2c(CO32-)
��c(Na+)��c(HCO3-)+ 2c(CO32-)
B.��![]() ��Һ�м����Ũ�ȵ���������c(Na+)��c(Cl-)
��Һ�м����Ũ�ȵ���������c(Na+)��c(Cl-)
C.��![]() ��Һ�м����Ũ�ȵ������
��Һ�м����Ũ�ȵ������![]() ��Һ��pH=13
��Һ��pH=13
D.��ˮ�м�������![]() ���壺
���壺![]() ����
����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��þ�������衢�������ĵ��ʼ��仯�����ڽ���ҵ���ɻ�����ҵ�����ӹ�ҵ��ʯ�ͻ����ȷ���Ӧ�ù㷺���ش��������⣺
(1)Fe3+�۲���ӵĹ������ʽ(�����Ų�ͼ)Ϊ__��
(2)���������______���塣�����γɶ��ֻ�����(��SiH4��Si2H4��)��SiH4�ķ��ӵ����幹��Ϊ____��Si2H4�����к��е���������������Ŀ֮��Ϊ____��
�л���������ԭ������֮һ������Ϊ̼ԭ��֮��ȿ����γɵ����ֿ����γ�˫����������Si��Ge��C��ͬ����۵�������ͬ������Si��Ge�����γ�˫����������ԭ����________
(3)Mg��Al��Si�ĵ�һ�������ɴ�С˳��______________
(4)Ca��Fe����ͬһ���ڣ��Һ����������ӹ�����ͬ��������Ca���۵㡢�е�ȶ��Ƚ���Fe�ͣ�ԭ����______��
(5)Ag����Ķѻ���ʽΪ�����������ܶѻ�(��ͼ��ʾ)��������Agԭ�ӵ���λ��Ϊ______����Agԭ�Ӱ뾶Ϊrcm�������ӵ�������ֵ��NA��ʾ����Ag������ܶ�Ϊ______g��cm-3(д������ʽ)��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ԫ��X��Y��Z��W��ԭ��������������X��Yͬ���������ڣ�Y�ǵؿ��к�������Ԫ�أ�Z�Ƕ�������ԭ�Ӱ뾶��������Ԫ�أ�W�ĵ��ʳ�������һ�ֵ���ɫ���塣����������ȷ����( )
A.Ԫ�صķǽ����ԣ�![]()
B.Z�ĵ����ڿ�����ȼ���������������Ӹ�����Ϊ![]() ��������
��������
C.Y�ļ���̬�⻯����ȶ���ǿ��W��
D.��ҵ��һ����õ���Ӧ�ε�ˮ��Һ��Z����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ������������ܹ��ﵽ��Ӧʵ��Ŀ����( )
ѡ�� | ʵ����������� | ʵ��Ŀ�� |
A | ����Һ�м��������������ټ����Ȼ�����Һ������ɫ���� | ������Һ���� |
B | �����£��� | ֤�������£� |
C | �����£��ⶨ����ʹ�����Һ��pH������pHС�ڴ���pH | ֤����ͬ�����£���ˮ��HCl����̶ȴ��� |
D | ��Ũ������̼��ϼ��ȣ�ֱ�ӽ����ɵ�����ͨ�������ij���ʯ��ˮ��ʯ��ˮ����� | ������������� |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com