
【题目】某化学研究性学习小组探究与铜有关的物质的性质,过程设计如下:
提出猜想:
问题1:在元素周期表中,铜与铝的位置很接近,氢氧化铝具有两性,氢氧化铜有两性吗?
问题2:铁和铜都有变价,一般情况下,Fe2+的稳定性弱于的Fe3+,Cu+的稳定性也弱于Cu2+吗?
问题3:硫酸铜溶液呈蓝色,铜与浓硝酸常温下反应生成的溶液也是蓝色吗?
实验探究:
Ⅰ.解决问题1:
(1)实验需配制100mL0.50molL-1CuSO4溶液,必需的玻璃仪器有胶头滴管、烧杯、___、___。
(2)为达到目的,某同学认为只要进行两次实验即可得出结论。请写出实验②的具体内容。
①向盛有CuSO4溶液的试管中滴加NaOH溶液至过量,观察生成的Cu(OH)2沉淀是否溶解;
②___。
Ⅱ.解决问题2的实验和现象如下:
①取一定量制得的氢氧化铜固体,于坩埚中灼烧,当温度达到80~100℃时得到黑色固体粉末;继续加热至1000℃以上,黑色粉末全部变成红色粉末氧化亚铜;
②取适量红色氧化亚铜粉末于洁净试管中,加入过量的稀硫酸,得到蓝色溶液,同时观察到试管底部还有红色固体存在。根据以上实验及现象回答下列问题:
(3)写出氧化亚铜与稀硫酸反应的离子方程式:___。
(4)从实验中可得出的结论:当温度在1000℃以上时___(填Cu2+或Cu+,下同)稳定,在酸性溶液中___稳定。
Ⅲ.解决问题3,某同学设计的实验如下:
取一铜片装入试管,加入适量的浓硝酸,观察溶液的颜色变化。
(5)另一同学认为此同学设计的实验有缺陷,原因是___。
(6)铜与浓硝酸反应溶液呈绿色,有同学认为这是生成的NO2溶于其中的原因。请设计实验说明此解释是否正确(只需要写出一种方法即可)。___
实验步骤 | 实验结论 |
【答案】玻璃棒 100mL容量瓶 取实验①中所得沉淀,滴加稀硫酸(或稀盐酸等)至过量,观察沉淀是否溶解 Cu2O+2H+=Cu+Cu2++H2O Cu+ Cu2+ 产生NO2气体,污染环境
实验步骤 | 实验结论 |
向反应后的溶液中通入足量空气 | 若溶液变蓝,则假设成立 |
【解析】
(1)根据配制一定物质的量浓度溶液的步骤,确认需要的玻璃仪器都有哪些,得出结果;
(2)问题1是氢氧化铜是否是两性氢氧化物,既能与酸反应,又能与碱反应,因此第2步是向沉淀中加入稀硫酸,观察沉淀是否溶解;
(3)根据实验现象进行分析,得出反应得到Cu和Cu2+;
(4)根据信息①完成;
(5)铜和浓硝酸反应生成NO2,NO2有毒,污染环境;
(6)向反应后的溶液中通入足量的空气,NO2和O2反应生成硝酸,据此分析。
(1)配制![]()
![]() 溶液还需要
溶液还需要![]() 容量瓶和玻璃棒。
容量瓶和玻璃棒。
(2)两性是指既能与酸反应,又能与碱反应,所以还需进行的实验是![]() 与酸的反应,实验具体内容为取实验
与酸的反应,实验具体内容为取实验![]() 中所得沉淀,滴加稀硫酸
中所得沉淀,滴加稀硫酸![]() 或稀盐酸等
或稀盐酸等![]() 至过量,观察沉淀是否溶解。
至过量,观察沉淀是否溶解。
(3)溶液变蓝说明有![]() 生成,红色固体是Cu,结合得失电子守恒和元素守恒可得反应的离子方程式:
生成,红色固体是Cu,结合得失电子守恒和元素守恒可得反应的离子方程式:![]() 。
。
(4)由题目信息可知![]() 受热分解先生成CuO,继续加热后生成
受热分解先生成CuO,继续加热后生成![]() ,即在高温下
,即在高温下![]() 更稳定。
更稳定。![]() 在酸性条件下会发生歧化反应,所以
在酸性条件下会发生歧化反应,所以![]() 在酸性条件下更稳定。
在酸性条件下更稳定。
(5)浓硝酸与铜反应生成的有毒气体![]() 会污染环境。
会污染环境。
(6)设计实验的目的是除去![]() ,而向反应后的溶液中通入空气即可将
,而向反应后的溶液中通入空气即可将![]() 除去:
除去:![]() 。
。


科目:高中化学 来源: 题型:
【题目】甲、乙两化学活动小组对中学化学教材中“氨的催化氧化”进行了实验探究。
(1)甲小组设计了如下图所示的实验装置(固定装置已略去)。

①若装置A中使用的药品是NH4HCO3固体,则A需要的仪器有试管、导管、橡胶塞和_______(填选项序号)。
a.锥形瓶 b.酒精灯 c.烧瓶 d.蒸发皿
②装置B的作用是___________________;装置D的作用是___________________。
③装置C中发生反应的化学方程式为________________________________。
④若A、B中药品足量,则可以观察到装置F中的实验现象是_____________________________。
⑤该装置存在的主要缺陷是___________________________________________________。
(2)乙小组认为可将甲小组的装置中A、B部分换成如图所示装置(其余部分相同)进行实验。

①烧瓶中加入的是过氧化钠固体,则分液漏斗中加入的最佳试剂是___________,U型管中加入的试剂是___________。
②此装置能产生大量氨气的原因是___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeBr2是一种黄绿色固体,某学习小组制备并探究它的还原性
Ⅰ.实验室制备FeBr2
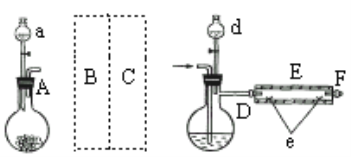
实验室用下图所示装置制取溴化亚铁.其中A为CO2发生装置,D和d中均盛有液溴,E为外套电炉丝的不锈钢管,e是两个耐高温的瓷皿,其中盛有细铁粉。
实验开始时先将铁粉加热至600℃~700℃,然后将干燥、纯净的CO2气流通入D中,E管中反应开始,不断将d中液溴滴入100℃~120℃的D中,经过几小时的连续反应,在铁管的一端沉积有黄绿色鳞片状溴化亚铁。
请回答:
(1)若在A中盛固体CaCO3,a中盛6mol/L盐酸,B处是装有饱和NaHCO3溶液的洗气瓶为使导入D中的CO2为干燥纯净的气体,则图中C处的装置和其中的试剂应是:________,为防止污染空气,实验时应在F处连接盛________的尾气吸收装置。
(2)反应过程中要不断通入CO2,其主要作用有两个:①是利用CO2把反应器中空气赶尽;②是________.
Ⅱ.探究FeBr2的还原性
(1)实验需要90 mL 0.1 mol·L-1FeBr2溶液,配制FeBr2溶液除烧杯、量筒、胶头滴管、玻璃棒外还需的玻璃仪器是________。
(2)取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1:Br-被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+被Cl2氧化成Fe3+。
设计实验证明假设2是正确的_______________________________
(3)实验证明:还原性Fe2+>Br-请用一个离子方程式来证明:_____________;
(4)若在40mL上述FeBr2溶液中通入3×10-3molCl2,则反应的离子方程式为:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A.氯气溶于水:Cl2+H2O=2H++Cl-+ClO-
B.Na2CO3溶液呈碱性的原因:CO![]() +H2O=HCO
+H2O=HCO![]() +OH-
+OH-
C.NaHCO3溶液中加足量Ba(OH)2溶液:HCO![]() +Ba2++OH-=BaCO3↓+H2O
+Ba2++OH-=BaCO3↓+H2O
D.酸性溶液中KIO3与KI反应生成I2:IO![]() +I-+6H+=I2+3H2O
+I-+6H+=I2+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人体内不可或缺的微量元素,其配合物的研究也是当今科研的重点之一。
![]() 基态Fe原子的价层电子轨道表达式为________________________________;同周期元素中,基态原子的未成对电子数比Fe多的元素为________
基态Fe原子的价层电子轨道表达式为________________________________;同周期元素中,基态原子的未成对电子数比Fe多的元素为________![]() 填元素符号
填元素符号![]() 。
。
![]() 常温下,五羰基铁
常温下,五羰基铁![]() 为黄色液体,其晶体类型为________________;CO与
为黄色液体,其晶体类型为________________;CO与![]() 互为等电子体,二者中沸点较高的是________,原因为________________________。
互为等电子体,二者中沸点较高的是________,原因为________________________。
![]() 普鲁士蓝的化学式为
普鲁士蓝的化学式为![]() ,碳原子与
,碳原子与![]() 形成配位键,其中提供孤电子对的是________
形成配位键,其中提供孤电子对的是________![]() 填元素符号
填元素符号![]() ,
,![]() 中碳原子的杂化方式为________,1mol普鲁士蓝中所含
中碳原子的杂化方式为________,1mol普鲁士蓝中所含![]() 键的数目为________________。
键的数目为________________。
![]() 邻羟基苯甲醛
邻羟基苯甲醛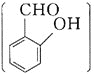 和对羟基苯甲醛
和对羟基苯甲醛 均能与
均能与![]() 溶液反应生成紫色配合物。对羟基苯甲醛在水中的溶解度略大于邻羟基苯甲醛在水中的溶解度,原因为________________________________________________________。
溶液反应生成紫色配合物。对羟基苯甲醛在水中的溶解度略大于邻羟基苯甲醛在水中的溶解度,原因为________________________________________________________。
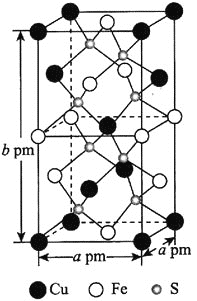
![]() 某含铁化合物的长方体晶胞结构如图所示,该化合物的化学式为________________,晶胞中距离Fe原子最近的S原子有________个,若阿伏加德罗常数的值为
某含铁化合物的长方体晶胞结构如图所示,该化合物的化学式为________________,晶胞中距离Fe原子最近的S原子有________个,若阿伏加德罗常数的值为![]() ,则该晶体的密度为________________________
,则该晶体的密度为________________________![]() 用含有
用含有![]() 、a、b的代数式表示
、a、b的代数式表示![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年,美国退出了《巴黎协定》实行再工业化战略,而中国却加大了环保力度,生动诠释了我国负责任的大国形象。近年来,我国大力加强温室气体CO2催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。
(1)已知:CO2(g)+ H2(g)![]() H2O(g) +CO(g) ΔH1 = + 41.1 kJmol-1
H2O(g) +CO(g) ΔH1 = + 41.1 kJmol-1
CO(g)+2H2(g)![]() CH3OH(g) ΔH2= -90.0 kJmol-1
CH3OH(g) ΔH2= -90.0 kJmol-1
写出CO2催化氢化合成甲醇的热化学方程式_________。
(2)为提高CH3OH产率,理论上应采用的条件是_________(填字母)。
a 高温高压 b 低温低压 c 高温低压 d 低温高压
(3)250℃、在体积为2.0 L的恒容密闭容器中加入6 mol H2、2 mol CO2和催化剂,10 min时反应达到平衡,测得c(CH3OH) = 0.75 mol· L-1。
① 前10 min的平均反应速率v(H2)=______ mol·L-1·min-1。
② 化学平衡常数的值 ______。
(4)以CO2(g)和H2(g)为原料合成甲醇,反应的能量变化如下图所示。

① 补全上图:图中A处应填入_____。
② 该反应需要加入铜-锌基催化剂。加入催化剂后,该反应的Δ H_____(填“变大”“变小”或“不变”)。
(5)CO2还可以与CH4反应生成CH3COOH。反应历程如下图1。(中间体的能量关系如虚框中曲线所示) 室温下某溶液中CH3COOH和CH3COO-两种微粒浓度随pH变化的曲线,如下图2。
①中间体①的能量______中间体②的能量。(填:“>”或“=”或“<”)
②从图2中得出,室温下,CH3COOH的电离常数值为____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普伐他汀是一种调节血脂的药物,其结构如图所示。下列关于普伐他汀的性质描述正确的是
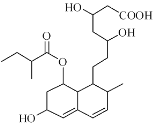
A.能发生加成、取代、消去反应
B.不能使酸性KMnO4溶液褪色
C.能与FeCl3溶液发生显色反应
D.1mol该物质最多可与3molNaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、人类生产、社会可持续发展密切相关,下列叙述正确的是
A.塑料、有机玻璃、光导纤维、碳纤维都是新型有机高分子材料
B.磁性氧化铁可用于制备红色颜料和油漆
C.用明矾溶液可清除铜镜表面的铜锈,是因为溶液中的A13+离子能与铜锈反应
D.肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗,该过程涉及胶体性质的应用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2SO3、NaHSO3、Na2S2O5可用于食品工业的漂白剂、防腐剂、抗氧化剂。已知:1molL﹣1Na2SO3溶液的pH≈9;1molL﹣1NaHSO3溶液的pH≈5。
(1)NaHSO3溶液的pH≈5的原因是_______(用化学用语并结合文字说明回答)。
(2)甲同学结合微粒观,应用所学知识,设计了如图所示实验,发现闭合开关后灵敏电流计指针发生偏转。

则:
①a电极为_______(填“正极”或“负极”);电极反应式为:______________。
②取少量Na2SO3溶液电极附近的混合液,加入_______,产生白色沉淀,证明产生了![]() 。
。
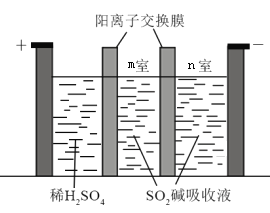
(3)制备Na2S2O5也可采用三室膜电解技术,装置如图所示,其中SO2碱吸收液中含有NaHSO3和Na2SO3,则阳极的电极反应式为_____________。电解后,_____________室的NaHSO3浓度增加。
(4)乙同学测定市面上某干红葡萄酒中Na2S2O5残留量,取50.00 mL葡萄酒样品于锥形瓶中,用装有0.010 mol·L1碘标准液的_________(填“酸式”或“碱式”)滴定管滴定至终点,消耗标准液10.00 mL。该样品中Na2S2O5的残留量为____________g·L1(以SO2计)。(已知:![]() )
)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com