
【题目】下列指定反应的离子方程式正确的是
A.氯气溶于水:Cl2+H2O=2H++Cl-+ClO-
B.Na2CO3溶液呈碱性的原因:CO![]() +H2O=HCO
+H2O=HCO![]() +OH-
+OH-
C.NaHCO3溶液中加足量Ba(OH)2溶液:HCO![]() +Ba2++OH-=BaCO3↓+H2O
+Ba2++OH-=BaCO3↓+H2O
D.酸性溶液中KIO3与KI反应生成I2:IO![]() +I-+6H+=I2+3H2O
+I-+6H+=I2+3H2O
科目:高中化学 来源: 题型:
【题目】三氯氢硅(SiHCl3)是光伏产业的一种关键化学原料,制备反应的方程式为Si(s)+3HCl(g)![]() SiHCl3(g)+H2(g),同时还有其他副反应发生。当反应体系的压强为0.05 MPa时,分别改变进料比[n(HCl)∶n(Si)]和反应温度,二者对SiHCl3产率影响如图所示。下列说法正确的是
SiHCl3(g)+H2(g),同时还有其他副反应发生。当反应体系的压强为0.05 MPa时,分别改变进料比[n(HCl)∶n(Si)]和反应温度,二者对SiHCl3产率影响如图所示。下列说法正确的是
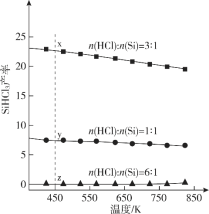
A. 降低压强有利于提高SiHCl3的产率
B. 制备SiHCl3的反应为放热反应
C. 温度为450 K,平衡常数:K(x)>K (y)>K (z)
D. 增加HCl的用量,SiHCl3的产率一定会增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学变化是有条件的。某小组同学探究I-与金属阳离子的氧化还原反应,实验过程如下。已知同浓度的稀溶液中氧化性:Ag+>Fe3+>Cu2+。
实狯 | 现象 | ||
| 编号 | 溶液x | |
I | 0.1mol/LFe(NO3)2,pH≈l | 溶液黄色立即加深,30秒后溶液变为褐色,无浑浊 | |
Ⅱ | KNO3和HNO3,其中c(NO3-)=0.3mol/L,pH≈1 | 1小时内溶液颜色始终保持无色 | |
Ⅲ | 0.1mol/LAgNO3 | 迅速变浑浊,离心分离后上层溶液为无色(经检测无I2),固体为黄色(AgI) | |
IV | 0.1mol/LCu(NO3)2 | 5秒后溶液由浅蓝色变为黄色并产生浑浊,离心分离后上层溶液为黄色(经检测有I2),固体为白色(CuI) | |
(1)根据实验I和Ⅱ,请回答下列问题。
①由“黄色立即加深”初步判断有I2生成,选择___(填试剂)进一步证实生成了I2。
②写出Fe3+与I-反应的离子方程式___,该条件下氧化性:Fe3+___I2(选填“>”或“<”)。
③实验Ⅱ的目的是___。
(2)实验Ⅳ中Cu2+与I-反应的离子方程式是___,甲同学得出氧化性:Cu2+>I2。
(3)乙同学认为甲同学的结论不合理,分析原因:实验Ⅲ应有I2生成,但却生成了AgI沉淀,因此推测实验Ⅳ中I2的生成,与CuI沉淀有关,故不能确定氧化性:Cu2+>I2,并用如图装置进行验证。K闭合后,较长时间发现两侧溶液均无明显变化。乙同学为了进一步判断Cu2+和I2的氧化性强弱,将左侧电极改为Cu电极,并向右侧溶液中加入少量___(填试剂),发现指针偏转,且左侧溶液颜色加深,证明该条件下氧化性:Cu2+___I2(选填“>”或“<”)。
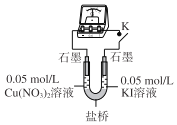
(4)该小组同学进一步分析认为,实验Ⅲ没有发生2Ag++2I-=2Ag+I2的反应,原因是生成AgI沉淀,反应物浓度迅速降低,不利于该反应进行;请分析实验Ⅳ发生氧化还原反应的原因是___。
(5)小组同学反思实验,反应体系中,各物质浓度对氧化还原反应是否发生都有一定的影响。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在由水电离出的c(H+)=1×10-12molL-1的溶液中,一定能大量共存的离子组是( )
A.NH![]() 、Ba2+、NO
、Ba2+、NO![]() 、Cl-B.Cl-、SO
、Cl-B.Cl-、SO![]() 、Na+、K+
、Na+、K+
C.SO![]() 、NO
、NO![]() 、Fe2+、Mg2+D.Na+、K+、ClO-、I-
、Fe2+、Mg2+D.Na+、K+、ClO-、I-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在照相底片的定影过程中,未曝光的溴化银(AgBr)常用硫代硫酸钠(Na2S2O3)溶解,反应生成Na3[Ag(S2O3)2];在废定影液中加人Na2S使Na3[Ag(S2O3)2]中的银转化为Ag2S,并使定影液再生。将Ag2S在高温下转化为Ag,就达到了回收银的目的。
(1)铜、银、金在元素周期表中位于同一族相邻周期,基态银原子的最外层电子排布式为 _______。
(2)Na、O、S简单离子半径由大到小的顺序为______________________。
(3)S2O32-离子结构如图所示,其中心硫原子的杂化轨道类型为_______________________。

(4)写出AgBr 溶于Na2S2O3溶液的离子反应方程式______________。Na3[Ag(S2O3)2]中存在的作用力有离子键、共价键、______________。
(5)在空气中灼烧Ag2S生成Ag和SO2,SO2 分子中硫原子的价层电子对数为_________,其分子空间构型为______________。 SO2易溶于水,原因是________________________________。
(6)现在人们已经有多种方法来测定阿伏加德罗常数,X射线衍射法就是其中的一种,通过对金晶体的X 射线衍射图象的分析,可以得出金晶体的晶胞属于面心立方晶胞(与铜的晶胞相似)。若金原子的半径为am,金的密度为ρg·cm-3,金的摩尔质量为Mg·mol -1,试通过这些数据列出计算阿伏加德罗常数的算式______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以碳酸锰矿(主要成分为MnCO3,另含FeO、Fe2O3、CaO等杂质)为主要原料生产锰酸锂(LiMn2O4)的工艺流程如下:
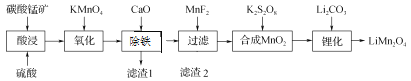
已知:部分离子沉淀的pH值。
离子 | 开始沉淀的pH值 | 沉淀完全时的pH值 |
Mn2+ | 8.8 | 10.8 |
Fe2+ | 7.5 | 9.5 |
Fe3+ | 2.2 | 3.5 |
(1) 为了提高碳酸锰矿浸岀的速率,在“酸浸”时可采取的措施有:①适当升高温度;②搅拌;③_____等。
(2) 氧化时发生的离子方程式:_________。
(3) 加入CaO“除铁”的原理是____________。
(4) 加入MnF2为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3 mol·L-1,则Ca2+的浓度为________mol·L-1[常温时,Ksp(CaF2)=2.7×10-11]。
(5) “锂化”是将MnO2和Li2CO3按4∶1的物质的量比配料,球磨3~5 h,然后升温至600~750 ℃,保温24 h,自然冷却至室温得产品。升温到515 ℃时,开始有CO2产生,比预计碳酸锂的分解温度(723 ℃)低得多。可能的原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组探究与铜有关的物质的性质,过程设计如下:
提出猜想:
问题1:在元素周期表中,铜与铝的位置很接近,氢氧化铝具有两性,氢氧化铜有两性吗?
问题2:铁和铜都有变价,一般情况下,Fe2+的稳定性弱于的Fe3+,Cu+的稳定性也弱于Cu2+吗?
问题3:硫酸铜溶液呈蓝色,铜与浓硝酸常温下反应生成的溶液也是蓝色吗?
实验探究:
Ⅰ.解决问题1:
(1)实验需配制100mL0.50molL-1CuSO4溶液,必需的玻璃仪器有胶头滴管、烧杯、___、___。
(2)为达到目的,某同学认为只要进行两次实验即可得出结论。请写出实验②的具体内容。
①向盛有CuSO4溶液的试管中滴加NaOH溶液至过量,观察生成的Cu(OH)2沉淀是否溶解;
②___。
Ⅱ.解决问题2的实验和现象如下:
①取一定量制得的氢氧化铜固体,于坩埚中灼烧,当温度达到80~100℃时得到黑色固体粉末;继续加热至1000℃以上,黑色粉末全部变成红色粉末氧化亚铜;
②取适量红色氧化亚铜粉末于洁净试管中,加入过量的稀硫酸,得到蓝色溶液,同时观察到试管底部还有红色固体存在。根据以上实验及现象回答下列问题:
(3)写出氧化亚铜与稀硫酸反应的离子方程式:___。
(4)从实验中可得出的结论:当温度在1000℃以上时___(填Cu2+或Cu+,下同)稳定,在酸性溶液中___稳定。
Ⅲ.解决问题3,某同学设计的实验如下:
取一铜片装入试管,加入适量的浓硝酸,观察溶液的颜色变化。
(5)另一同学认为此同学设计的实验有缺陷,原因是___。
(6)铜与浓硝酸反应溶液呈绿色,有同学认为这是生成的NO2溶于其中的原因。请设计实验说明此解释是否正确(只需要写出一种方法即可)。___
实验步骤 | 实验结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有抗菌作用的白头翁素衍生物H的合成路线如图所示:

已知:
![]()
![]() R—HC=CH—R’
R—HC=CH—R’
ii.R—HC=CH—R’![]()
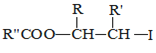
iii.R—HC=CH—R’![]()
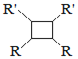
![]() 以上R、
以上R、![]() 、
、![]() 代表氢、烷基或芳基等
代表氢、烷基或芳基等![]()
![]() 属于芳香烃,其名称是______。
属于芳香烃,其名称是______。
![]() 的结构简式是______。
的结构简式是______。
![]() 由F生成G的反应类型是______。
由F生成G的反应类型是______。
![]() 由E与
由E与![]() 在一定条件下反应生成F的化学方程式是______;此反应同时生成另外一个有机副产物且与F互为同分异构体,此有机副产物的结构简式是______。
在一定条件下反应生成F的化学方程式是______;此反应同时生成另外一个有机副产物且与F互为同分异构体,此有机副产物的结构简式是______。
![]() 下列说法正确的是______
下列说法正确的是______![]() 选填字母序号
选填字母序号![]() 。
。
A.G存在顺反异构体
B.由G生成H的反应是加成反应
C.1molG最多可以与1mol![]() 发生加成反应
发生加成反应
D.1molF或1molH与足量NaOH溶液反应,均消耗2molNaOH
![]() 以乙烯为起始原料,结合已知信息选用必要的无机试剂合成
以乙烯为起始原料,结合已知信息选用必要的无机试剂合成 ,写出合成路线
,写出合成路线![]() 用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件
用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件![]() 。______。
。______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4A(s)+3B(g)=2C(g)+D(g),经2 min后,B的浓度减少了0.6mol/L。下列反应速率的表示正确的是
A. 用A表示的反应速率是0.4 mol/(L·min)
B. 用C表示的反应速率是0.2 mol/(L·min)
C. 2 min末时的反应速率,用B表示是0.3 mol/(L·min)
D. 在这2 min内用B表示的反应速率的值是减小的,C表示的反应速率逐渐增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com