
【题目】下列实验操作及现象能够达到对应实验目的是( )
选项 | 实验操作及现象 | 实验目的 |
A | 向溶液中加入盐酸无现象,再加入氯化钡溶液产生白色沉淀 | 检验溶液中有 |
B | 常温下,向饱和 | 证明常温下, |
C | 常温下,测定盐酸和醋酸溶液的pH:盐酸pH小于醋酸pH | 证明相同条件下,在水中HCl电离程度大于 |
D | 将浓硫酸与碳混合加热,直接将生成的气体通入足量的澄清石灰水,石灰水变浑浊 | 检验气体产物中 |
A.AB.BC.CD.D
科目:高中化学 来源: 题型:
【题目】Na2SO3、NaHSO3、Na2S2O5可用于食品工业的漂白剂、防腐剂、抗氧化剂。已知:1molL﹣1Na2SO3溶液的pH≈9;1molL﹣1NaHSO3溶液的pH≈5。
(1)NaHSO3溶液的pH≈5的原因是_______(用化学用语并结合文字说明回答)。
(2)甲同学结合微粒观,应用所学知识,设计了如图所示实验,发现闭合开关后灵敏电流计指针发生偏转。

则:
①a电极为_______(填“正极”或“负极”);电极反应式为:______________。
②取少量Na2SO3溶液电极附近的混合液,加入_______,产生白色沉淀,证明产生了![]() 。
。
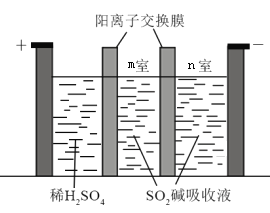
(3)制备Na2S2O5也可采用三室膜电解技术,装置如图所示,其中SO2碱吸收液中含有NaHSO3和Na2SO3,则阳极的电极反应式为_____________。电解后,_____________室的NaHSO3浓度增加。
(4)乙同学测定市面上某干红葡萄酒中Na2S2O5残留量,取50.00 mL葡萄酒样品于锥形瓶中,用装有0.010 mol·L1碘标准液的_________(填“酸式”或“碱式”)滴定管滴定至终点,消耗标准液10.00 mL。该样品中Na2S2O5的残留量为____________g·L1(以SO2计)。(已知:![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用如下装置制备乙酸乙酯。下列有关分析不正确的是

A. b中导管不能插入液面下,否则会阻碍产物的导出
B. 固体酒精是一种白色凝胶状纯净物,常用于餐馆或野外就餐
C. 乙酸乙酯与![]() 互为同分异构体
互为同分异构体
D. 乙酸、水、乙醇羟基氢的活泼性依次减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LED产品的使用为城市增添色彩。如图是氢氧燃料电池驱动LED发光的一种装置示意图。下列有关叙述正确的是( )

A.该装置将化学能最终只转化为电能
B.b处为电池正极,发生还原反应
C.a处通入O2
D.通入O2的电极上发生的电极反应为O2+4H++4e-=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在复习元素化合物的性质时,做了如下学习笔记,请你一起完成。
氯气的颜色为__________;由氯的原子结构示意图推测,氯气具有很强的______ 性。为了证明推测是否正确,进行如下实验:
I:将红热的铁丝伸入盛满氯气的集气瓶,观察铁丝在氯气中燃烧,有大量棕黄色烟。该反应的化学方程式是___________。
II:在空气中点燃H2,然后将导管缓缓伸入盛满氯气的集气瓶,可观察到H2在氯气中安静燃烧,产生______色的火焰,瓶口有白雾的现象。
由实验I、II可知,上述推测_____(填“正确”或“不正确”)。
III:将氯气溶于水,制得氯水。下列物质不能与新制氯水反应的是_____。
A.Na2CO3溶液 B.FeCl2溶液 C.AgNO3 溶液 D.CuCl2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验是学习理解化学知识的基础,它以其魅力和丰富的内涵在化学学习中发挥着独特的功能和作用。请回答下列问题:
实验室欲配制100mL1mol·L-1的Na2CO3溶液。
(1)配制上述溶液,下列没有用到的仪器是__(填标号)。
A.烧杯 B.大试管 C.胶头滴管 D.100mL容量瓶
(2)除上述仪器外,还一定用到的玻璃仪器是__。
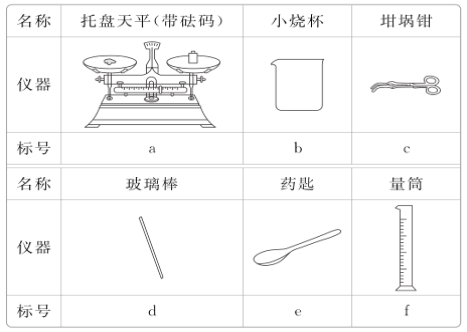
(3)从下表中选择称量Na2CO3·10H2O固体所需要的仪器有__(填标号)。
(4)下列情况使所配溶液的浓度如何变化?
①未洗涤溶解Na2CO3·10H2O的烧杯__(填“偏大”“偏小”或“不变”,后同)。
②容量瓶使用前用蒸馏水洗过,内壁附有水珠__。
③定容时加蒸馏水超过了刻度线,将多出的液体吸出__。
④定容时俯视容量瓶刻度线__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.PM2.5是指大气中直径≤2.5×10-6 m的颗粒物,则受PM2.5污染的大气定能产生丁达尔效应
B.根据电解质在水溶液中电离的程度,将电解质分为强电解质和弱电解质
C.黑火药的配方为“一硫二硝三木炭”,其中“硝”是指硝酸
D.![]() 、
、![]() 是制造氢弹的原料,它们是同一种核素
是制造氢弹的原料,它们是同一种核素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】东晋《华阳国志·南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为___,3d能级上的未成对电子数为___。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是___。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为___,提供孤电子对的成键原子是___。
③氨的沸点___(填“高于”或“低于”)膦(PH3),原因是___。
(3)单质铜及镍都是由___键形成的晶体;元素铜与镍的第二电离能分别为ICu=1958kJ·mol-1、INi=1753kJ·mol-1,ICu>INi的原因是___。
(4)某镍白铜合金的立方晶胞结构如图所示。
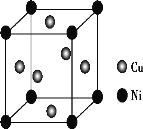
①晶胞中铜原子与镍原子的数量比为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如右图,关闭活塞K,向A中充入1 molX、1 molY,向B中充入2 molX、2molY, 此时A、B的容积都是a L。在相同温度和催化剂存在的条件下,使两容器中各自发生下述反应:X(g)+Y(g)![]() 2Z(g)+W(g);△H<0。A保持恒压,B保持恒容,达平衡时,A的体积为1.4a L。下列说法正确的是
2Z(g)+W(g);△H<0。A保持恒压,B保持恒容,达平衡时,A的体积为1.4a L。下列说法正确的是
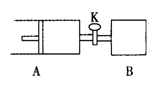
A.反应速率:v(B)<v(A)
B.平衡时Y的体积分数:A>B
C.打开K后达平衡时A的体积为2.4a L
D.A容器中X的转化率为80%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com