
【题目】![]() 时,下列溶液中,离子浓度关系正确的是
时,下列溶液中,离子浓度关系正确的是![]()
A.![]() 的氨水稀释10倍后,其
的氨水稀释10倍后,其![]() ,则
,则![]()
B.浓度相同的![]() ,三种溶液中的
,三种溶液中的![]()
C.将相同浓度的氨水与盐酸等体积混合,所得溶液中的离子浓度关系:![]()
D.将![]() 与
与![]() 溶液等体积混合,测得溶液pH为7,则a与b的关系:
溶液等体积混合,测得溶液pH为7,则a与b的关系:![]()
 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:
【题目】铁是人体内不可或缺的微量元素,其配合物的研究也是当今科研的重点之一。
![]() 基态Fe原子的价层电子轨道表达式为________________________________;同周期元素中,基态原子的未成对电子数比Fe多的元素为________
基态Fe原子的价层电子轨道表达式为________________________________;同周期元素中,基态原子的未成对电子数比Fe多的元素为________![]() 填元素符号
填元素符号![]() 。
。
![]() 常温下,五羰基铁
常温下,五羰基铁![]() 为黄色液体,其晶体类型为________________;CO与
为黄色液体,其晶体类型为________________;CO与![]() 互为等电子体,二者中沸点较高的是________,原因为________________________。
互为等电子体,二者中沸点较高的是________,原因为________________________。
![]() 普鲁士蓝的化学式为
普鲁士蓝的化学式为![]() ,碳原子与
,碳原子与![]() 形成配位键,其中提供孤电子对的是________
形成配位键,其中提供孤电子对的是________![]() 填元素符号
填元素符号![]() ,
,![]() 中碳原子的杂化方式为________,1mol普鲁士蓝中所含
中碳原子的杂化方式为________,1mol普鲁士蓝中所含![]() 键的数目为________________。
键的数目为________________。
![]() 邻羟基苯甲醛
邻羟基苯甲醛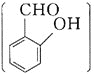 和对羟基苯甲醛
和对羟基苯甲醛 均能与
均能与![]() 溶液反应生成紫色配合物。对羟基苯甲醛在水中的溶解度略大于邻羟基苯甲醛在水中的溶解度,原因为________________________________________________________。
溶液反应生成紫色配合物。对羟基苯甲醛在水中的溶解度略大于邻羟基苯甲醛在水中的溶解度,原因为________________________________________________________。
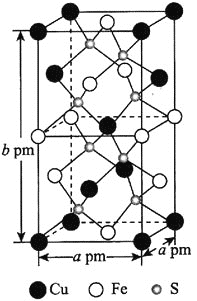
![]() 某含铁化合物的长方体晶胞结构如图所示,该化合物的化学式为________________,晶胞中距离Fe原子最近的S原子有________个,若阿伏加德罗常数的值为
某含铁化合物的长方体晶胞结构如图所示,该化合物的化学式为________________,晶胞中距离Fe原子最近的S原子有________个,若阿伏加德罗常数的值为![]() ,则该晶体的密度为________________________
,则该晶体的密度为________________________![]() 用含有
用含有![]() 、a、b的代数式表示
、a、b的代数式表示![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是一些晶体的结构示意图。请回答下列问题:
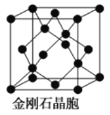
(1)下图为金刚石晶胞,则1个金刚石晶胞含有_________个碳原子。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,则r=_________a。
(2)下图为钛酸钡晶体的晶胞结构,该晶体经X—射线分析得出,重复单位为立方体,顶点位置被Ti4+所占据,体心位置被Ba2+所占据,棱心位置被O2-所占据。
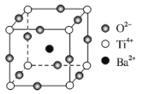
①在该物质的晶体中,每个Ti4+周围与它距离最近且相等的Ti4+有_____个,它们的空间构型为_____。O2-的钡配位数是______。
②若将Ti4+置于晶胞的体心,Ba2+置于晶胞顶点,则O2-处于立方体的______位置。
(3)PbS是一种重要的半导体材料,具有NaCl型结构(如下图),其中阴离子采用面心立方最密堆积方式,X—射线衍射实验测得PbS的晶胞参数为a=0.594nm。

①已知坐标参数:A(0,0,0),B(![]() ,
,![]() ,0),则C 的坐标参数为 ________ 。
,0),则C 的坐标参数为 ________ 。
②PbS晶体的密度为______ gcm-3。(列出计算式即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏伽德罗常数的值。关于常温下pH=2的H2SO4溶液,溶液中不存在H2SO4分子,但存在HSO4一离子,下列说法错误的是
A.每升溶液中的H+数目为0.01NA
B.Na2SO4溶液中:c(Na+)=2c(SO42-)>c(H+)=2c(OH-)
C.向稀硫酸中逐滴滴加浓硫酸,溶液中![]() 减小
减小
D.NaHSO4不是弱电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化合物的同分异构体数目与分子式为C3H6Cl2的同分异构体数目相同的是
A.![]() B.C8H8O2(含苯环且属于酸)
B.C8H8O2(含苯环且属于酸)
C.C3H8O2D.C7H8O(含苯环)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2SO3、NaHSO3、Na2S2O5可用于食品工业的漂白剂、防腐剂、抗氧化剂。已知:1molL﹣1Na2SO3溶液的pH≈9;1molL﹣1NaHSO3溶液的pH≈5。
(1)NaHSO3溶液的pH≈5的原因是_______(用化学用语并结合文字说明回答)。
(2)甲同学结合微粒观,应用所学知识,设计了如图所示实验,发现闭合开关后灵敏电流计指针发生偏转。

则:
①a电极为_______(填“正极”或“负极”);电极反应式为:______________。
②取少量Na2SO3溶液电极附近的混合液,加入_______,产生白色沉淀,证明产生了![]() 。
。
(3)制备Na2S2O5也可采用三室膜电解技术,装置如图所示,其中SO2碱吸收液中含有NaHSO3和Na2SO3,则阳极的电极反应式为_____________。电解后,_____________室的NaHSO3浓度增加。
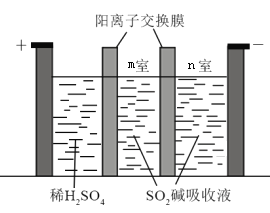
(4)乙同学测定市面上某干红葡萄酒中Na2S2O5残留量,取50.00 mL葡萄酒样品于锥形瓶中,用装有0.010 mol·L1碘标准液的_________(填“酸式”或“碱式”)滴定管滴定至终点,消耗标准液10.00 mL。该样品中Na2S2O5的残留量为____________g·L1(以SO2计)。(已知:![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液的电导率越大,导电能力越强。用![]() 的NaOH溶液滴定
的NaOH溶液滴定![]() 浓度均为
浓度均为![]() 的
的![]() 和
和![]() 溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是
溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是![]()
![]()
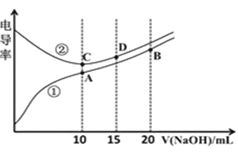
A.C点溶液呈酸性,A点溶液呈碱性
B.A点溶液中:![]()
C.在相同温度下,A、B、C三点溶液中水的电离程度:![]()
D.D点溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以镍黄铁矿为原料制备![]() 的工艺流程如下:
的工艺流程如下:
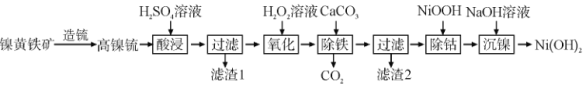
已知:①高镍锍的主要成分为![]() 、
、![]() 、
、![]() 、
、![]() 的低价硫化物及合金;
的低价硫化物及合金;
②氧化性:![]() ;
;
③![]() ,
,![]() ,
,![]() 。
。
回答下列问题:
(1)“酸浸”时,![]() 溶液需过量,其目的是________。
溶液需过量,其目的是________。
(2)“氧化”时反应的化学方程式为________,若用![]() 代替
代替![]() 溶液,使
溶液,使![]() 转化为
转化为![]() ,则需
,则需![]() 至少为________
至少为________![]() 。
。
(3)“除铁”的原理是________。
(4)“过滤”时滤渣1的主要成分是________。
(5)“沉镍”后需过滤、洗涤,证明沉淀已洗涤干净的方法是________________。若“沉镍”后的滤液中![]() ,则滤液的
,则滤液的![]() ________。
________。
(6)“除钴”时,发生反应的离子方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在复习元素化合物的性质时,做了如下学习笔记,请你一起完成。
氯气的颜色为__________;由氯的原子结构示意图推测,氯气具有很强的______ 性。为了证明推测是否正确,进行如下实验:
I:将红热的铁丝伸入盛满氯气的集气瓶,观察铁丝在氯气中燃烧,有大量棕黄色烟。该反应的化学方程式是___________。
II:在空气中点燃H2,然后将导管缓缓伸入盛满氯气的集气瓶,可观察到H2在氯气中安静燃烧,产生______色的火焰,瓶口有白雾的现象。
由实验I、II可知,上述推测_____(填“正确”或“不正确”)。
III:将氯气溶于水,制得氯水。下列物质不能与新制氯水反应的是_____。
A.Na2CO3溶液 B.FeCl2溶液 C.AgNO3 溶液 D.CuCl2溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com