
【题目】含氮化合物对环境、生产和人类生命活动等具有很大的影响。请按要求回答下列问题:
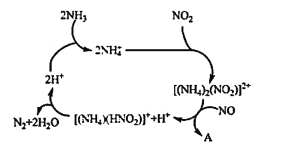
(1)利用某分子筛作催化剂,NH3可脱除工厂废气中的NO、NO2,反应机理如图所示。A包含的物质为H2O和___(填化学式)。
(2)研究氮氧化物与悬浮在大气中的海盐粒子的相互作用时,涉及如下反应:
①2NO2(g)+NaCl(g)=NaNO3(g)+ClNO(g) ΔH1<0
②2NO(g)+Cl2(g)=2ClNO(g) ΔH2<0
则4NO2(g)+2NaCl(g)=2NaNO3(g)+2NO(g)+Cl2(g)的ΔH=___(用ΔH1和ΔH2表示)。
若反应①在绝热密闭容器中进行,实验测得NO2(g)的转化率随时间的变化示意图如图所示,NO2(g)的转化率α(NO2)在t3-t4时间降低的原因是___。

(3)工业上利用氨气生产氢氰酸(HCN)的反应为CH4(g)+NH3(g)![]() HCN(g)+3H2(g) ΔH>0。在一定温度下,向2L密闭容器中加入nmolCH4和2molNH3平衡时NH3体积分数随n变化的关系如图所示。
HCN(g)+3H2(g) ΔH>0。在一定温度下,向2L密闭容器中加入nmolCH4和2molNH3平衡时NH3体积分数随n变化的关系如图所示。

a点时,CH4的转化率为___%;平衡常数:K(a)___K(b)(填“>”“=”或“<”)。
(4)肌肉中的肌红蛋白(Mb)与O2结合生成MbO2,其反应原理可表示为Mb(aq)+O2(g)![]() MbO2(aq),该反应的平衡常数可表示为K=
MbO2(aq),该反应的平衡常数可表示为K=![]() ,在一定条件下达到平衡时,测得肌红蛋白的结合度(α)[α=
,在一定条件下达到平衡时,测得肌红蛋白的结合度(α)[α=![]() ×100%]与p(O2)的关系如图所示。研究表明正反应速率V正=k正·c(Mb)·p(O2),逆反应速率V逆=k逆·c(MbO2)(其中k正和k逆分别表示正反应和逆反应的速率常数)。
×100%]与p(O2)的关系如图所示。研究表明正反应速率V正=k正·c(Mb)·p(O2),逆反应速率V逆=k逆·c(MbO2)(其中k正和k逆分别表示正反应和逆反应的速率常数)。
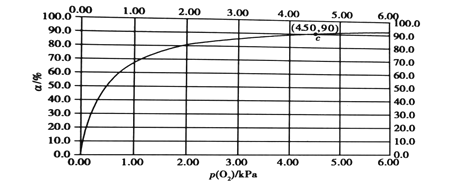
①试写出平衡常数K与速率常数k正、k逆的关系式:K=___(用含有k正、k逆的式子表示)。
②试求出图中c(4.50,90)点时,上述反应的平衡常数K=___kPa-1。已知k逆=60s-1,则速率常数k正=___s·kPa-1。
【答案】N2 2ΔH1-ΔH2 因反应为放热反应且反应容器为绝热容器,随着反应正向进行,体系的温度升高,t3-t4时间段温度升高使平衡逆向移动,转化率降低 25 = ![]() 2 120
2 120
【解析】
(1)由图示可得到方程[(NH4)2(NO2)]2++NO===[(NH4)(HNO2)]++A+H+,根据化学反应前后原子种类和数目不变可知,A为H2O和N2,故答案为:N2;
(2)根据盖斯定律,由反应①×2-②可得4NO2(g)+2NaCl(g)=2NaNO3(g)+2NO(g)+Cl2(g),则ΔH=2ΔH1-ΔH2,因反应为放热反应且反应容器为绝热容器,随着反应正向进行,体系的温度升高,t3-t4时间段温度升高使平衡逆向移动,NO2的转化率降低,故答案为:2ΔH1-ΔH2;因反应为放热反应且反应容器为绝热容器,随着反应正向进行,体系的温度升高,t3-t4时间段温度升高使平衡逆向移动,转化率降低;
(3)a点时,n(CH4)=2mol,平衡时NH3的体积分数为30%,设转化的CH4的物质的量为x,列三段式有:
则有![]() ,解得x=0.5,则CH4的转化率为
,解得x=0.5,则CH4的转化率为![]() ,由于a点和b点的温度相同,所以K(a)=K(b),故答案为:25%;=;
,由于a点和b点的温度相同,所以K(a)=K(b),故答案为:25%;=;
(4)①已知正反应速率v正=k正·c(Mb)·P(O2),逆反应速率v逆=k逆·c(MbO2),平衡时,v正=v逆,则k正·c(Mb)·P(O2)= k逆·c(MbO2),即 ,故答案为:
,故答案为:![]() ;
;
②由图可知,c点时,P(O2)=4.5kPa,![]() ,则生成的c(MbO2)=0.9c(Mb)初始,平衡时c(Mb)=0.1 c(Mb)初始,则
,则生成的c(MbO2)=0.9c(Mb)初始,平衡时c(Mb)=0.1 c(Mb)初始,则 ,已知K逆=60s-1,又
,已知K逆=60s-1,又![]() ,则速率常数k正=120s-1·kPa-1,故答案为:2;120。
,则速率常数k正=120s-1·kPa-1,故答案为:2;120。


 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
【题目】下列事实,不能用勒夏特列原理解释的是
A.氯水中有下列平衡Cl2+H2 OHCl + HClO,当加入AgNO3溶液后,溶液颜色变浅
B.对2HI(g)H2(g)+I2 (g),平衡体系增大压强可使颜色变深
C.反应CO+NO2CO2+NO ΔH <0,升高温度可使平衡向逆反应方向移动
D.合成NH3反应,为提高NH3的产率,理论上应采取降低温度的措施
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】衣康酸是一种重要的有机化学中间体,可通过下列方法合成:

①B→C的反应类型__________。
②有机物A可能的结构简式为__________。
③D发生加聚反应所得有机物的结构简式为__________。
④写出同时满足下列条件的C的一种同分异构体E的结构简式:__________。
Ⅰ.能与盐酸反应;
Ⅱ.E为五元环状化合物,分子中有4种不同化学环境的氢。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是( )
A.18gT2O和18gH2O中含有的质子数均为10NA
B.1L1mol/L的Na2CO3溶液中CO32-和HCO3-离子数之和为NA
C.78gNa2O2与足量CO2充分反应转移的电子数目为2NA
D.加热条件下,含0.2molH2SO4的浓硫酸与足量铜反应,生成SO2的分子数小于0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,改变弱酸RCOOH溶液的pH,溶液中RCOOH分子的物质的量分数δ(RCOOH)随之改变,0.1mol/L甲酸(HCOOH)与丙酸(CH3CH2COOH)溶液中δ(RCOOH)与pH的关系如图所示。下列说法正确的是( )
已知:δ(RCOOH)=![]()
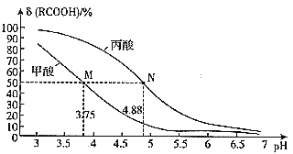
A.等浓度的HCOONa和CH3CH2COONa两种溶液中水的电离程度比较:前者>后者
B.将等浓度的HCOOH溶液与HCOONa溶液等体积混合,所得溶液中:c(HCOOH)+2c(H+)>c(OH-)+c(HCOO-)
C.图中M、N两点对应溶液中的Kw比较:前者>后者
D.1mol/L丙酸的电离常数K﹤10-4.88
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】核磁共振氢谱是研究有机物结构的有力手段之一。
(1)分子式均为C3H6O2的两种混合物,在核磁共振氢谱上观察到氢原子的峰有两种情况,第一种情况中峰面积比是1:1,第二种情况中峰面积之比为3:2:1,由此推断该混合物的组成可能是__(写出一种情况即可)。
(2)有一种有机物的分子式为C7H8O,苯环上有1个羟基,请写出该有机物可能的结构简式__,核磁共振氢谱上观察到氢原子的峰面积比为__(对应上一空所填物质)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是基本的有机化工原料。用A和常见的有机物可合成一种醚类香料和一种缩醛类香料(M)。具体合成路线如图所示(部分反应条件略去):
是基本的有机化工原料。用A和常见的有机物可合成一种醚类香料和一种缩醛类香料(M)。具体合成路线如图所示(部分反应条件略去):
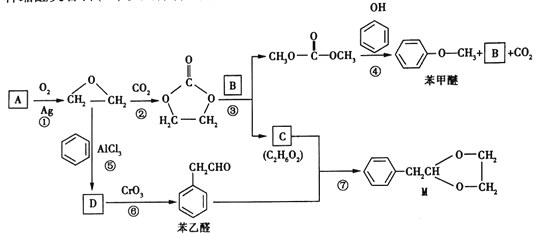
已知:①![]() 。
。
②D为单取代芳香族化合物且能与金属钠反应;每个D分子中只含有1个氧原子,D中氧元素的质量分数约为13.1%。试回答下列问题:
(1)A的名称是_______,图中缩醛(M)的分子式是______。
(2)B的结构简式为___________。
(3)⑤的化学方程式为_____________。
(4)⑥的反应类型是___________。
(5)请写出核磁共振氢谱有4组峰,且峰面积之比为3∶2∶2∶1,并含有苯环和![]() 结构的苯乙醛的所有同分异构体的结构简式:_____________。
结构的苯乙醛的所有同分异构体的结构简式:_____________。
(6)参照 的合成路线,设计一条由
的合成路线,设计一条由![]() 氯丙烷和必要的无机试剂制备
氯丙烷和必要的无机试剂制备 的合成路线(注明必要的反应条件):_________________________。
的合成路线(注明必要的反应条件):_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组的同学用如图所示装置研究有关电化学的问题。当闭合该装置的开关时,观察到电流表的指针发生了偏转。请根据如图所示,回答下列问题:
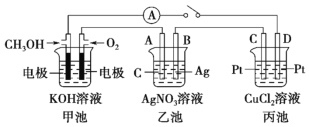
(1)甲池为_____(填“原电池”“电解池”或“电镀池”),通入 CH3OH 电极的电极反应为_____。
(2)乙池中 A(石墨)电极的名称为_____(填“正极”“负极”或“阴极”“阳极”),总反应化学方程式为__________。
(3)当乙池中 B 极质量增加 5.4 g 时,甲池中理论上消耗 O2 的体积为_____mL(标准状况),丙池中_____(填“C”或“D”)极析出_____g 铜。
(4)若丙中电极不变,将其溶液换成 NaCl 溶液,开关闭合一段时间后,甲中溶液的 pH将_____(填“增大”“减小”或“不变”,下同),丙中溶液的 pH 将______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com