
【题目】①CH3CH=CHCH3、② ![]() 、③
、③![]() 、④CH3CH2CH(C2H5)2、⑤35Cl、⑥O2、⑦-CH3、⑧CH2=CH-CH=CH2、⑨37Cl、⑩O3
、④CH3CH2CH(C2H5)2、⑤35Cl、⑥O2、⑦-CH3、⑧CH2=CH-CH=CH2、⑨37Cl、⑩O3
(1)互为同系物的有___________________(用序号表示)。
(2)互为同位素的有___________________(用序号表示)。
(3)③的系统名称_____________________,②的系统名称_____________________。
(4)写出⑧与Br2 按照1:1发生加成反应所得产物的结构简式______________________________。
(5)等物质的量的⑦和⑩的电子数之比为____________。
【答案】③④ ⑤⑨ 2,3,3-三甲基戊烷 2-甲基-1-丙烯 CH2Br-CHBr-CH=CH2 CH2Br-CH=CH-CH2Br 3:8
【解析】
结构相似,分子组成相差若干个CH2原子团的同一类有机物的,互称为同系物。同位素是指质子数相同,中子数不同的同一种元素的不同核素。根据有机物的结构特点判断其名称、分析其化学性质,据此解答。
(1)③![]() 、④CH3CH2CH(C2H5)2均是烷烃,分子式不同,互为同系物。
、④CH3CH2CH(C2H5)2均是烷烃,分子式不同,互为同系物。
(2)⑤35Cl、⑨37Cl的质子数相同中子数不同,二者互为同位素。
(3)③的键线式为![]() ,主链含有5个碳原子,含有3个甲基作支链,则其系统名称2,3,3-三甲基戊烷;②的结构简式为
,主链含有5个碳原子,含有3个甲基作支链,则其系统名称2,3,3-三甲基戊烷;②的结构简式为![]() ,含有碳碳双键,1个甲基作支链,则系统名称2-甲基-1-丙烯。
,含有碳碳双键,1个甲基作支链,则系统名称2-甲基-1-丙烯。
(4)⑧是CH2=CH-CH=CH2,与Br2按照1:1发生加成反应,可以是1,2-加成或1,4-加成,则所得产物的结构简式为CH2Br-CHBr-CH=CH2或CH2Br-CH=CH-CH2Br。
(5)等物质的量的⑦和⑩的电子数之比为9:24=3:8。


科目:高中化学 来源: 题型:
【题目】下图是某化学兴趣小组探究化学能转变为电能的装置。

(1)当电极a为Zn、电极b为Fe、电解质溶液为稀硫酸时,SO42-向_____极(填a或b)移动,正极的电极反应式为:_____________
(2)若依据氧化还原反应:Cu+2Fe3+=Cu2++2Fe2+设计原电池,电极a为石墨、则电极b为电池的_______极,发生的电极反应式为:_______,电极a上发生的电极反应为______(填“氧化”或“还原”)反应。
(3)燃料电池的工作原理是将燃料和氧化剂(如O2)反应所放出的化学能直接转化为电能。现设计一燃料电池,以电极a为正极,电极b为负极,氢气为燃料,采用酸性溶液为电解液;则氢气应通入_____极(填a或b)。a极发生电极反应式为:________。当电路中通过2mol电子时,理论上消耗标况下氧气_____L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为解决日益加剧的温室效应等问题,科学家正在研究建立如下图所示的二氧化碳新循环体系:
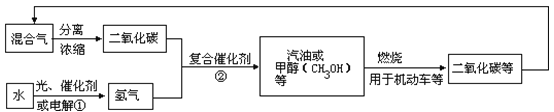
上述关系图能反映的化学观点或化学思想有 ( )
①化学变化中元素种类是守恒的;②燃烧时化学能可以转化为热能和光能;③光能或电能可以转化为化学能;④无机物和有机物可以相互转化;⑤二氧化碳也是一种重要的资源。
A. ①②③ B. ①②④⑤ C. ①④⑤ D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,密闭容器中进行反应:2SO2(g)+O2(g)2SO3(g)△H<0。测得v正(SO2)随反应时间(t)的变化如图所示,其中在t2时改变了某个条件。下列有关说法正确的是( )

A. t2时改变的条件可能是:升温或缩小容器体积
B. t1时平衡常数K1小于t3时平衡常数K2
C. t1时平衡混合气的![]() > t3时平衡混合气的
> t3时平衡混合气的![]()
D. t1时平衡混合气中的SO3的体积分数等于t3时平衡混合气中SO3的体积分数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于非金属元素Si、N、S、Cl的叙述,正确的是 ( )
A.通常情况下,它们的单质均为气体
B.它们在自然界中都存在游离态形式
C.每种元素都只有一种氧化物
D.它们都有对应的含氧酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种短周期元素的原子半径及主要化合价如下表
元素代号 | X | Y | Z | M | R | w |
原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 | 0.077 |
主要化合价 | +1 | +6 -2 | +5 -3 | -2 | +3 | +4 -4 |
已知:X是短周期中最活泼的金属,且与R同周期。请用相应的化学用语或者化学符号回答下列问题。
(1)R在元素周期表中的位置为________________。
(2)X与M按原子个数比1:1构成的物质的电子式为_____________;所含化学键类型___________。
(3)X+、Y2-、M2-、R3+离子半径大小顺序为__________________________(用离子符号表示)。
(4)请用电子式表示WY2的形成过程___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,两种碳酸盐MCO3(M分别为A和B两种离子)的沉淀溶解平衡曲线如图所示。已知:pM=lgc(M),p(CO32)=lgc(CO32)。已知ACO3比BCO3溶解度更大。(不考虑阴阳离子的水解)。下列说法正确的是

A. 线a表示ACO3的溶解平衡曲线
B. 该温度下,向ACO3的饱和溶液中加入Na2CO3溶液,一定能产生沉淀
C. 向0.1L 1mol/L的BCl2溶液中加入Na2CO3固体,当加入Na2CO3固体的质量为116.6g时,B2+离子恰好沉淀完全(B2+离子为10—5mol/L时认为沉淀完全)
D. ACO3的Ksp=10—4.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某试液中只可能含有下列K+、NH4+、Fe2+、Al3+、Cl-、SO42-、CO32-、AlO2-中的若干种离子,离子浓度均为0.1mol·L-1。某同学进行了如下实验:
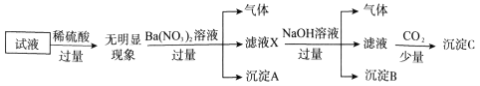
下列说法正确的是( )
A. 无法确定原试液中是否含有Al3+、Cl-
B. 滤液X中大量存在的阳离子有NH4+、Fe2+和Ba2+
C. 无法确定沉淀C的成分
D. 原溶液中存在的离子为NH4+、Fe2+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于钠及其化合物的叙述正确的是
A.金属钠可以保存在无水酒精中
B.受热时碳酸氢钠比碳酸钠稳定
C.过氧化钠可用作呼吸面具的供氧剂
D.不能用玻璃瓶盛放稀氢氧化钠溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com