
����Ŀ��һ���¶���,�ܱ������н��з�Ӧ��2SO2(g)+O2(g)2SO3(g)��H<0�����v��(SO2)�淴Ӧʱ��(t)�ı仯��ͼ��ʾ��������t2ʱ�ı���ij�������������й�˵����ȷ����( )

A. t2ʱ�ı�����������ǣ����»���С�������
B. t1ʱƽ�ⳣ��K1С��t3ʱƽ�ⳣ��K2
C. t1ʱƽ��������![]() > t3ʱƽ��������
> t3ʱƽ��������![]()
D. t1ʱƽ�������е�SO3�������������t3ʱƽ��������SO3���������
���𰸡�D
��������
A��������ƽ�����淴Ӧ�����ƶ���������SO2��ͻȻ������������ֱ���ﵽ��ƽ�⣬����С�������ƽ��������Ӧ�����ƶ���������SO2��ͻȻ������Сֱ���ﵽ��ƽ�⣬��ƽ��ʱ������SO2�����ھ�ƽ����A�����B��t2ʱ�ı�������������SO2��ͻȻ������С����ƽ��ʱ������SO2�����ƽ��ʱ��ͬ���ı���������ں��º�ѹ�����³�������ʼSO2��O2�ȱ�����SO2��O2��t3ʱ��ƽ����t1ʱ��ƽ��Ϊ���º�ѹ�µĵ�Чƽ�⣬�¶�û�б䣬��ѧƽ�ⳣ�����䣬t1ʱƽ�ⳣ��K1����t3ʱƽ�ⳣ��K2��B�������C��t3ƽ��ʱ��t1ƽ��ʱΪ���º�ѹ�µĵ�Чƽ�⣬��t1ʱƽ��������![]() ����t3ʱƽ��������
����t3ʱƽ��������![]() ��C�������D��t3ƽ��ʱ��t1ƽ��ʱΪ���º�ѹ�µĵ�Чƽ�⣬t1ʱƽ�������е�SO3�������������t3ʱƽ��������SO3�����������D����ȷ����ѡD��
��C�������D��t3ƽ��ʱ��t1ƽ��ʱΪ���º�ѹ�µĵ�Чƽ�⣬t1ʱƽ�������е�SO3�������������t3ʱƽ��������SO3�����������D����ȷ����ѡD��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��EΪԭ��������������Ķ���������Ԫ�أ�AԪ�ص�һ�ֵ�������Ȼ����Ӳ�����ʣ�BΪ����õķǽ���Ԫ�أ�CԪ�ص�ԭ�ӵĵ��Ӳ�����������������3����DԪ������ϼ�Ϊ+6�ۡ�
(1)D�����ڱ��е�λ���� _____________��E�����ӽṹʾ��ͼ_____________��
(2)C��D �γɻ�����ĵ���ʽΪ_____________��
(3)A��D��E����Ԫ�ص�����������Ӧˮ�����������ǿ������˳����______��
(4)��B��C��D�γɵļ����Ӱ뾶�ɴ�С��˳����________________��
(5)B�γɵ��⻯��е��E�γɵ��⻯��е�_______(����������������)��ԭ����___________��
(6)DBn�������������������Գ�������ȫû���ƻ����ã���һ�ֺ��з�չDZ����������������ʵ�Ħ������Ϊ146g/mol�������ʵĻ�ѧʽΪ____����֪DBn���¶ȸ���45��ʱΪ��̬��DBn����____���塣
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��±�����ڼ��Դ���Һ���ܷ�����ȥ��Ӧ�����磬

�÷�ӦʽҲ�ɱ�ʾΪ

�����Ǽ����л��������ת����ϵ��

(1)����ϵͳ��������������A��������_____________��
(2)������ͼ�У���_________�Ƿ�Ӧ����___________�Ƿ�Ӧ��
(3)������E����Ҫ�Ĺ�ҵԭ�ϣ�д����D����E�Ļ�ѧ����ʽ��_________��
(4)C2�Ľṹ��ʽ�ǣ�F1�Ľṹ��ʽ��______________��F1��F2��Ϊ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Ӧ��������Y��Ũ����4min����0�����4mol/L������Y��ʾ�÷�Ӧ��4min�ڵ�ƽ����Ӧ����Ϊ ( )
A. 16 mol/(L��min) B. 4 mol/(L��min)
C. 2 mol/(L��min) D. 1 mol/(L��min)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ѧϰ���о���ѧ��һ����Ҫ���������з����������
A.Na2CO3��K2O��������B.Na2O��Na2SiO3������������
C.KOH��Na2CO3�����ڼ�D.H2SO4��HNO3��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����άͪ���ˮ��Һ��һ�ֳ����ĵ���������������άͪͨ�������HI3�γɾ�άͪ�⣬��ṹ��ʾ���� (ͼ�����߱�ʾ���)������˵������ȷ����( )
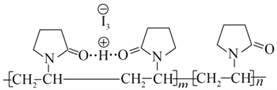
A. ��άͪ�ĵ����� B. ��άͪ���ӵľۺ϶�Ϊ2m+n
B. ��άͪ���ӵľۺ϶�Ϊ2m+n
C. ��άͪ��NaOHˮ��Һ��ˮ������� D. ��άͪ�;�άͪ�ⶼ��ˮ���Ե�
D. ��άͪ�;�άͪ�ⶼ��ˮ���Ե�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����CH3CH=CHCH3���� ![]() ����
����![]() ����CH3CH2CH(C2H5)2����35Cl����O2����-CH3����CH2=CH-CH=CH2����37Cl����O3
����CH3CH2CH(C2H5)2����35Cl����O2����-CH3����CH2=CH-CH=CH2����37Cl����O3
��1����Ϊͬϵ�����___________________������ű�ʾ����
��2����Ϊͬλ�ص���___________________������ű�ʾ����
��3������ϵͳ����_____________________������ϵͳ����_____________________��
��4��д������Br2 ����1:1�����ӳɷ�Ӧ���ò���Ľṹ��ʽ______________________________��
��5�������ʵ������������ĵ�����֮��Ϊ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��Ӧԭ���������������й㷺��Ӧ�á�����������ȷ����
A.�����¼����ɽ�ˮ�ֽ���������������ͷ�����
B.�������ʹ������������β����ƽ��ת����
C.ȼ�ϵ���ܽ���ѧ����ȫת��Ϊ����
D.Ϊ��ֹ�����ܵ�����ʴ��Ӧ�������ܵ����Դ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȡһ֧Ӳ�ʴ��Թܣ�ͨ���ű���ʳ��ˮ�ķ����Ⱥ��ռ����Թܼ���Ͱ��Թ�����(��ͼ)�����ж����Թ��ڷ����ķ�Ӧ�������˵����ȷ����
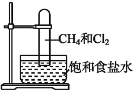
A. �˷�Ӧ����Ҳ�ɷ���
B. �����Cl2��Ӧ��IJ���ֻ��CH3Cl��HCl
C. ʢ�ű���ʳ��ˮ��ˮ�۵ײ�����������������
D. CH4��Cl2��ȫ��Ӧ��Һ��������Һ������Թ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com