
【题目】在一定温度下,某容积可变的密闭容器中,建立下列化学平衡:C(s)+H2O(g) ![]() CO(g)+H2(g)。下列叙述中不能说明上述可逆反应已达到化学平衡状态的是 ( )
CO(g)+H2(g)。下列叙述中不能说明上述可逆反应已达到化学平衡状态的是 ( )
A.体系的压强不再发生变化
B.v正(CO)=v逆(H2O)
C.生成n mol CO的同时生成n mol H2
D.1 mol H—H键断裂的同时断裂2 mol H—O键
科目:高中化学 来源: 题型:
【题目】中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。CO2可转化成有机物实现碳循环。在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示。

(1)从3min到9min,v(CO2)=__mol·L-1·min-1(计算结果保留2位有效数字)。
(2)能说明上述反应达到平衡状态的是__(填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B.混合气体的压强不随时间的变化而变化
C.单位时间内生成1molH2,同时生成1molCH3OH
D.混合气体的平均相对分子质量不随时间的变化而变化
(3)平衡时CO2的转化率为__%。
(4)平衡混合气体中CO2(g)和H2(g)的质量之比是__。
(5)第3分钟时v正(CH3OH)__第9分钟时v逆(CH3OH)(填“>”、“<”“=”或“无法比较”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列两个图象:

下列反应中符合上述图象的是( )
A. N2(g)+3H2(g)![]() 2NH3(g) ΔH<0
2NH3(g) ΔH<0
B. 2SO3(g)![]() 2SO2(g)+O2(g) ΔH>0
2SO2(g)+O2(g) ΔH>0
C. 4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH<0
4NO(g)+6H2O(g) ΔH<0
D. H2(g)+CO(g)![]() C(s)+H2O(g) ΔH>0
C(s)+H2O(g) ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家在某杂志上发表研究报告称,利用铬同位素的系统分析发现,“古代大气氧含量高于现代水平的1%”。铬的同位素有![]() 、
、![]() 、
、![]() 、
、![]() 。铬及其化合物在生活、生产中有广泛应用。回答下列问题:
。铬及其化合物在生活、生产中有广泛应用。回答下列问题:
(1)基态![]() 的价层电子排布图为_________
的价层电子排布图为_________
(2)交警用“酒精仪”查酒驾,其化学反应原理如下:
2K2Cr2O7+3CH3CH2OH+8H2SO4→3CH3COOH+2Cr2(SO4)3+2K2SO4+11H2O
①CH3CH2OH、CH3COOH的沸点高于对应的CH3OCH3(二甲醚)、HCOOCH3(甲酸甲酯),其主要原因是___________。
②CH3COOH分子中碳原子的杂化类型是______;CH3COOH分子中σ键和π键数目之比为_________。
③K2SO4晶体中阴离子的空间构型是________。上述反应中,只含极性键的极性分子有________(填分子式)。
(3)晶体铬的晶胞结构如图1所示,其堆积模型为___________;铬原子的配位数为___________。

(4)铬的一种氧化物晶胞结构如图2所示。六棱柱边长为a nm,高为b nm,NA代表阿伏加德罗常数的值。该晶体的化学式为______;该晶体的密度ρ=_______g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000mol/LNaOH溶液分别滴定浓度均为0.1000mol/L HX溶液和HY溶液各20.00mL,得到2条滴定曲线,如图所示。下列叙述正确的是
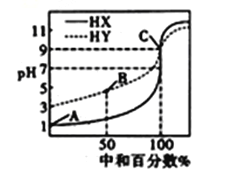
A. 由图可推知,HX是弱酸,而HY是强酸
B. 滴定HY时,可用甲基橙作指示剂,当溶液颜色由橙色变为黄色时,达到滴定终点
C. 滴定至B点时,溶液中:c(Y-)>c(Na+)>c(HY)>c(H+)>c(OH-)
D. 若A、C两点对应的pH分别为1、9,则两点处水电离出的c(H+)之比为104∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒(V)为过渡元素,可形成多价态化合物,全钒液流电池是一种新型的绿色环保储能系统,工作原理如下图:

已知:
离子种类 | VO2+ | VO2+ | V3+ | V2+ |
颜色 | 黄色 | 蓝色 | 绿色 | 紫色 |
(1)全钒液流电池放电时V2+发生氧化反应,该电池放电时总反应式是_______
(2)当完成储能时,正极溶液的颜色是 __________
(3)质子交换膜的作用是_________
(4)含钒废水会造成水体污染,对含钒废水(除VO2+外,还含Fe3+等)进行综合处理可实现钒资源的回收利用,流程如下:

已知溶液酸碱性不同钒元素的存在形式不同:
钒的化合价 | 酸性 | 碱性 |
+4价 | VO2+ | VO(OH)3- |
+5价 | VO2+ | VO43- |
①滤液中钒元素的主要存在形式为_______
②滤渣在空气中由灰白色转变为红褐色,用化学用语表示加入NaOH后生成沉淀的反应过程_______________、____________。
③萃取、反萃取可实现钒的分离和富集,过程可简单表示为(HA为有机萃取剂):
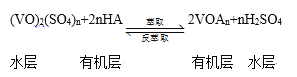
萃取时必须加入适量碱,其原因是 __________
④纯钒可由熔盐电解法精炼,粗钒(含杂质)作____极。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下在20 mL 0.1 mol·L-1 Na2CO3溶液中逐滴加入40 mL浓度为0.1 mol·L-1的盐酸,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。下列说法正确的是

A. 在混合溶液中,H2CO3、HCO3-、CO32-能大量共存
B. 当pH=7时,溶液中离子浓度的大小关系为c(Na+)>c(Cl-)>c(HCO3-)>c(H+)>c(CO32-)>c(OH-)
C. 已知在25℃时,CO32-水解反应的平衡常数即水解常数Kh![]() =2.0×10-4,当溶液中(HCO3-):(CO32-)= 2:1时,溶液的pH=10
=2.0×10-4,当溶液中(HCO3-):(CO32-)= 2:1时,溶液的pH=10
D. Kh不受温度的影响,升高温度,溶液中各种离子浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.0 mol.L-1 的氨水中存在下列平衡:NH3·H2O![]() NH4++OH-,若想增大NH4+的浓度, 而不增大OH-的浓度,应采取的措施是 ( )
NH4++OH-,若想增大NH4+的浓度, 而不增大OH-的浓度,应采取的措施是 ( )
A. 适当升高温度 B. 加入NaOH固体
C. 通入NH3 D. 加入NH4Cl固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关键环节训练A、B、C、D四物质有如下转化关系(反应条件和部分产物已略去):A![]() B
B![]() C
C![]() D。回答下列问题:
D。回答下列问题:
(1)若A为气态氢化物和D能通过化合反应生成一种盐,则:
①简述检验A气体的方法________;
②写出D制备B的离子方程式_______;
③写出由A生成B的化学方程式_________;
④某同学用干燥的圆底烧瓶收集一瓶A气体,用滴入酚酞的水做喷泉实验,能观察到美丽的红色喷泉。用方程式解释喷泉呈红色的原因____________;
(2)若A与B反应能生成一种淡黄色固体单质。写出B→C的化学方程式__________;
(3)若A是金属单质,C是一种淡黄色固体。写出C的电子式________说出C的一种用途_______。
(4)学法题:结合A![]() B
B![]() C
C![]() D转化关系总结出连续氧化的物质有______(至少写出三组物质)。
D转化关系总结出连续氧化的物质有______(至少写出三组物质)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com