
【题目】常温下,用0.1000mol/LNaOH溶液分别滴定浓度均为0.1000mol/L HX溶液和HY溶液各20.00mL,得到2条滴定曲线,如图所示。下列叙述正确的是
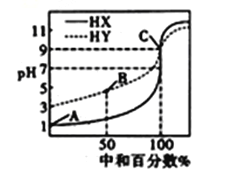
A. 由图可推知,HX是弱酸,而HY是强酸
B. 滴定HY时,可用甲基橙作指示剂,当溶液颜色由橙色变为黄色时,达到滴定终点
C. 滴定至B点时,溶液中:c(Y-)>c(Na+)>c(HY)>c(H+)>c(OH-)
D. 若A、C两点对应的pH分别为1、9,则两点处水电离出的c(H+)之比为104∶1
科目:高中化学 来源: 题型:
【题目】以甲醇为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:

(1)B极上的电极反应式为 。
(2)若用该燃料电池做电源,用石墨做电极电解硫酸铜溶液,当阳极收集到11.2L(标准状况)气体时,消耗甲醇的质量为 克,若要使溶液复原,可向电解后的溶液中加入的物质有 。
(3)目前已开发出用电解法制取ClO2的新工艺。

①上图示意用石墨做电极,在一定条件下电解饱和食盐水制取ClO2。若用上述甲醇燃料电池进行电解,则电解池的电极a接甲醇燃料电池的 极( 填A或B) ,写出阳极产生ClO2的电极反应式:__________。
②电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为_________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将H2S转化为可再利用的资源是能源研究领域的重要课题。
(1)H2S的转化
Ⅰ | 克劳斯法 |
|
Ⅱ | 铁盐氧化法 |
|
Ⅲ | 光分解法 |
|
① 反应Ⅰ的化学方程式是________。
② 反应Ⅱ:____+ 1 H2S ==____Fe2+ + ____S↓ + ____(将反应补充完整)。
③ 反应Ⅲ体现了H2S的稳定性弱于H2O。结合原子结构解释二者稳定性差异的原因:_______。
(2)反应Ⅲ硫的产率低,反应Ⅱ的原子利用率低。我国科研人员设想将两个反应耦合,实现由H2S高效产生S和H2,电子转移过程如图。

过程甲、乙中,氧化剂分别是______。
(3)按照设计,科研人员研究如下。
① 首先研究过程乙是否可行,装置如图。经检验,n极区产生了Fe3+,p极产生了H2。n极区产生Fe3+的可能原因:

ⅰ.Fe2+ - e- = Fe3+
ⅱ.2H2O -4e-=O2 +4H+,_______(写离子方程式)。经确认,ⅰ是产生Fe3+的原因。过程乙可行。
② 光照产生Fe3+后,向n极区注入H2S溶液,有S生成,持续产生电流,p极产生H2。研究S产生的原因,设计如下实验方案:______。 经确认,S是由Fe3+氧化H2S所得,H2S不能直接放电。过程甲可行。
(4)综上,反应Ⅱ、Ⅲ能耦合,同时能高效产生H2和S,其工作原理如图。

进一步研究发现,除了Fe3+/Fe2+ 外,I3-/I- 也能实现如图所示循环过程。结合化学用语,说明I3-/I- 能够使S源源不断产生的原因:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
①标准状况下,1LHCl和1LH2O的物质的量相同;
②常温常压下,1gH2和14gN2的体积相同;
③28gCO的体积为22.4L;
④两种物质的物质的量相同,则它们在标准状况下的体积也相同;
⑤同温同体积时,气体的物质的量越大,则压强越大;
⑥同温同压下,气体的密度与气体的相对分子质量成正比
A. ①③④⑥B. ②⑤⑥C. ⑤⑥D. ①⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是

A. 气态氢化物的稳定性:H2O>NH3>SiH4
B. 氢元素与其他元素可形成共价化合物或离子化合物
C. 上图所示实验可证明元素的非金属性:Cl>C>Si
D. 用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,某容积可变的密闭容器中,建立下列化学平衡:C(s)+H2O(g) ![]() CO(g)+H2(g)。下列叙述中不能说明上述可逆反应已达到化学平衡状态的是 ( )
CO(g)+H2(g)。下列叙述中不能说明上述可逆反应已达到化学平衡状态的是 ( )
A.体系的压强不再发生变化
B.v正(CO)=v逆(H2O)
C.生成n mol CO的同时生成n mol H2
D.1 mol H—H键断裂的同时断裂2 mol H—O键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0族 |
第二周期 | ① | ② | ③ | |||||
第三周期 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
第四周期 | ⑨ | ⑩ |
(1)在这些元素中,化学性质最不活泼的是:__(填元素符号),
(2)在最高价氧化物对应的水化物中,酸性最强的化合物的分子__,碱性最强的化合物的电子式是:__。
(3)用电子式表示元素④与⑥的化合物的形成过程:__。
(4)表示①与⑦的化合物的电子式__,该化合物是由__(填“极性”或“非极性”)键形成的。
(5)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是_(用化学式表示)。
(6)元素③的简单氢化物的结构式__,在常温下和元素⑦的单质反应的离子方程式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能说明反应X(g)+2Y(g)![]() 2Z(g)达到化学平衡状态的是( )
2Z(g)达到化学平衡状态的是( )
A..X、Y、Z的物质的量之比为1:2:2
B.X、Y、Z的浓度不再发生变化
C.反应速率v(X)=v(Y)
D.单位时间内生成nmolX的同时生成2nmolY
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化锡可用作媒染剂。利用如图所示装置可以制备四氯化锡(部分夹持装置已略去);

有关信息如下表:
化学式 | SnCl2 | SnCl4 |
熔点/℃ | 246 | 33 |
沸点/℃ | 652 | 144 |
其他性质 | 无色晶体,易氧化 | 无色液体,易水解 |
回答下列问题:
(1)甲装置中仪器A的名称为_______。
(2)用甲装置制氯气,MnO4 被还原为Mn2+,该反应的离子方程式为________。
(3)将装置如图连接好,检查气密性,慢慢滴入浓盐酸,待观察到_______(填现象)后,开始加热丁装置,锡熔化后适当增大氯气流量,继续加热丁装置,此时继续加热丁装置的目的是:
①促进氯气与锡反应;②__________。
(4)如果缺少乙装置,丁装置中可能产生SnCl2杂质,产生SnCl2杂质的化学方程式为______,以下试剂中可用于检测是否产生SnCl2的有_____
A.H2O2溶液 B.FeCl3溶液(滴有KSCN) C.AgNO3溶液 D.溴水
(5)己装置的作用是_____。
A.除去未反应的氯气,防止污染空气
B.防止空气中CO2气体进入戊装置
C.防止水蒸气进入戊装置的试管中使产物水解
D.防止空气中O2进入戊装置的试管中使产物氧化
(6)反应中用去锡粒1.19g,反应后在戊装置的试管中收集到2.35gSnCl4,则SnCl4的产率为____(保留3位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com