
【题目】能说明反应X(g)+2Y(g)![]() 2Z(g)达到化学平衡状态的是( )
2Z(g)达到化学平衡状态的是( )
A..X、Y、Z的物质的量之比为1:2:2
B.X、Y、Z的浓度不再发生变化
C.反应速率v(X)=v(Y)
D.单位时间内生成nmolX的同时生成2nmolY
科目:高中化学 来源: 题型:
【题目】一定条件下反应2AB(g)![]() A2(g)+B2(g)达到平衡状态的标志是
A2(g)+B2(g)达到平衡状态的标志是
A. 单位时间内生成nmolA2,同时消耗2n molAB
B. 容器内,3种气体AB、A2、B2共存
C. 混合气的平均分子量不再改变
D. 容器中各组分的体积分数不随时间变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000mol/LNaOH溶液分别滴定浓度均为0.1000mol/L HX溶液和HY溶液各20.00mL,得到2条滴定曲线,如图所示。下列叙述正确的是
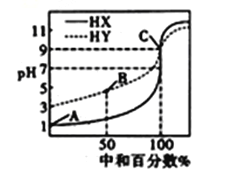
A. 由图可推知,HX是弱酸,而HY是强酸
B. 滴定HY时,可用甲基橙作指示剂,当溶液颜色由橙色变为黄色时,达到滴定终点
C. 滴定至B点时,溶液中:c(Y-)>c(Na+)>c(HY)>c(H+)>c(OH-)
D. 若A、C两点对应的pH分别为1、9,则两点处水电离出的c(H+)之比为104∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下在20 mL 0.1 mol·L-1 Na2CO3溶液中逐滴加入40 mL浓度为0.1 mol·L-1的盐酸,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。下列说法正确的是

A. 在混合溶液中,H2CO3、HCO3-、CO32-能大量共存
B. 当pH=7时,溶液中离子浓度的大小关系为c(Na+)>c(Cl-)>c(HCO3-)>c(H+)>c(CO32-)>c(OH-)
C. 已知在25℃时,CO32-水解反应的平衡常数即水解常数Kh![]() =2.0×10-4,当溶液中(HCO3-):(CO32-)= 2:1时,溶液的pH=10
=2.0×10-4,当溶液中(HCO3-):(CO32-)= 2:1时,溶液的pH=10
D. Kh不受温度的影响,升高温度,溶液中各种离子浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的量的计算:
(1)2 mol尿素[CO(NH2)2]含__个H原子,所含氧原子跟_____g H2O所含氧原子个数相等。
(2)2.4g 镁中含______mol电子,在与足量盐酸反应中产生标准状况下的氢气体积为 ______L。
(3)30.9gNaR含有Na+ 0.3mol,则NaR的摩尔质量为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.0 mol.L-1 的氨水中存在下列平衡:NH3·H2O![]() NH4++OH-,若想增大NH4+的浓度, 而不增大OH-的浓度,应采取的措施是 ( )
NH4++OH-,若想增大NH4+的浓度, 而不增大OH-的浓度,应采取的措施是 ( )
A. 适当升高温度 B. 加入NaOH固体
C. 通入NH3 D. 加入NH4Cl固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分,请回答下列问题:
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0族 | |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)在这些元素中,单质的化学性质最不活泼的是___(填元素符号)。
(2)③的气态氢化物的电子式___,②④形成的气态化合物的结构式___。
(3)这些元素形成的最高价氧化物的水化物中,碱性最强的化合物为___(填物质的化学式),写出它的电子式:___;酸性最强的含氧酸为___(填物质的化学式),写出它的电离方程式:___。
(4)在②和③两种元素中,非金属性较强的是___(填元素名称),②的单质可以和③的最高价氧化物的水化物反应,请写出有关化学方程式___。
(5)②与Si元素分别形成的最高价氧化物,___的熔点更高,原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法错误的是( )
A.1mol的Fe分别与足量的盐酸和稀硫酸反应,电子转移数目均为2NA
B.125gCuSO4·5H2O晶体中含有0.5NA个Cu2+
C.常温常压下,等质量的SO2、S2含有相同的分子数
D.1molNa2O2固体中含原子总数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳是引起“温室效应”的主要物质,应该减少二氧化碳的排放。
(1)有一种用CO2生产甲醇燃料的方法:
已知:CO2(g)+3H2(g)═CH3OH(g)+H2O(l)△H=-akJmol-1;
CH3OH(g)═CH3OH(l)△H=-bkJmol-1;
2H2(g)+O2(g)═2H2O(l)△H=-ckJmol-1;
则表示CH3OH(l)燃烧热的热化学方程式为:__________________________________________。
(2)在一定温度下的2L固定容积的密闭容器中,通入2mol CO2和3molH2,发生的反应为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H<0,测得CO2(g)和CH3OH(g)的浓度随时间变化如右图所示。
CH3OH(g)+H2O(g)△H<0,测得CO2(g)和CH3OH(g)的浓度随时间变化如右图所示。

①从0min到10min,v(H2)=_____________。
②下列措施中能使![]() 增大的是______(选填编号)。
增大的是______(选填编号)。
A.升高温度 B.恒温恒容下充入He(g)
C.将H2O(g)从体系中分离 D.恒温恒容再充入2molCO2和3molH2
③计算该温度下此反应的平衡常数K=____________(填分数或保留两位有效数字)。若改变_________条件(填编号),可使K=1。
A.增大压强B.增大反应物浓度C.降低温度D.升高温度 E.加入催化剂
(3)某甲醇燃料电池原理如图所示

①则M区发生的电极反应式为_______________________________。
②用上述电池做电源,用图2装置电解饱和食盐水(电极均为惰性电极).则该电解反应的总反应的离子方程式为:____________________________。
假设溶液体积为300mL,当溶液的pH值为13时(在室温下测定),理论上消耗甲醇的质量为________________(忽略溶液体积变化)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com