
【题目】四氯化锡可用作媒染剂。利用如图所示装置可以制备四氯化锡(部分夹持装置已略去);

有关信息如下表:
化学式 | SnCl2 | SnCl4 |
熔点/℃ | 246 | 33 |
沸点/℃ | 652 | 144 |
其他性质 | 无色晶体,易氧化 | 无色液体,易水解 |
回答下列问题:
(1)甲装置中仪器A的名称为_______。
(2)用甲装置制氯气,MnO4 被还原为Mn2+,该反应的离子方程式为________。
(3)将装置如图连接好,检查气密性,慢慢滴入浓盐酸,待观察到_______(填现象)后,开始加热丁装置,锡熔化后适当增大氯气流量,继续加热丁装置,此时继续加热丁装置的目的是:
①促进氯气与锡反应;②__________。
(4)如果缺少乙装置,丁装置中可能产生SnCl2杂质,产生SnCl2杂质的化学方程式为______,以下试剂中可用于检测是否产生SnCl2的有_____
A.H2O2溶液 B.FeCl3溶液(滴有KSCN) C.AgNO3溶液 D.溴水
(5)己装置的作用是_____。
A.除去未反应的氯气,防止污染空气
B.防止空气中CO2气体进入戊装置
C.防止水蒸气进入戊装置的试管中使产物水解
D.防止空气中O2进入戊装置的试管中使产物氧化
(6)反应中用去锡粒1.19g,反应后在戊装置的试管中收集到2.35gSnCl4,则SnCl4的产率为____(保留3位有效数字)。
【答案】蒸馏烧瓶 2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O 丁装置内充满黄绿色气体 使SnCl4气化,利于从混合物中分离出来 Sn+2HCl=SnCl2+H2↑ BD AC 90.0%
【解析】
SnCl4极易水解,应在无水环境下进行进行,A装置制备氯气,由于盐酸易挥发,制备的Cl2中含有HCl及水蒸气,乙中盛放饱和食盐水除去HCl,可以降低氯气的溶解,丙中浓硫酸吸收水蒸气,干燥氯气,并用氯气排尽装置中空气,防止影响实验。氯气与Sn在丁处试管中反应生成SnCl4,反应生成SnCl4的为气态,在戊处冷却收集得到液态SnCl4,干燥管中碱石灰吸收未反应的氯气,防止污染环境,同时吸收空气中的水蒸气,防止进入收集SnCl4的试管使其水解。
(1)根据装置图可知:甲装置中仪器A的名称为蒸馏烧瓶;
(2)在A中KMnO4与浓盐酸发生氧化还原反应产生氯气,发生反应的离子方程式为:2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O;
(3)若整个装置中充分氯气时,即丁装置充满黄绿色气体,再加热熔化锡粒合成SnCl4,加热丁装置,促进氯气与锡反应,使生成的SnCl4气化,有利于从混合物中分离出来,便于在戊处冷却收集;
(4)如果缺少乙装置,氯气中混有的HCl气体与Sn反应产生SnCl2进而氢气,使SnCl4产率降低,且氯气与氢气反应可能发生爆炸;反应产生SnCl2的方程式为:Sn+2HCl=SnCl2+H2↑;
A.H2O2溶液 可以将 Sn2+氧化为Fe3+,但没有明显现象,a错误;
B.与FeCl3溶液(滴有KSCN)混合,不出现红色,则含有SnCl2,否则无SnCl2,b正确;
C.使用AgNO3溶液可以检验氯离子,不能检验二价锡,c错误;
D.与溴水混合,若橙色褪去,则含有SnCl2,否则无SnCl2,d正确;
故合理选项是BD;
(5)己装置是干燥管,干燥管中碱石灰吸收未反应的氯气,防止污染环境,同时吸收空气中的水蒸气,防止进入收集SnCl4的试管使其水解,故合理选项是AC;
(6)用去锡粒1.19g,其物质的量为n(Sn)=1.19g÷119g/mol=0.01mol,根据Sn原子守恒可知在理论生成SnCl4为0.01mol,则SnCl4的产率为![]() ×100%=90.0%。
×100%=90.0%。


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】常温下,用0.1000mol/LNaOH溶液分别滴定浓度均为0.1000mol/L HX溶液和HY溶液各20.00mL,得到2条滴定曲线,如图所示。下列叙述正确的是
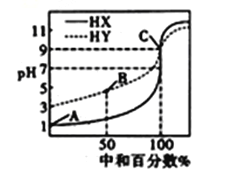
A. 由图可推知,HX是弱酸,而HY是强酸
B. 滴定HY时,可用甲基橙作指示剂,当溶液颜色由橙色变为黄色时,达到滴定终点
C. 滴定至B点时,溶液中:c(Y-)>c(Na+)>c(HY)>c(H+)>c(OH-)
D. 若A、C两点对应的pH分别为1、9,则两点处水电离出的c(H+)之比为104∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分,请回答下列问题:
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0族 | |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)在这些元素中,单质的化学性质最不活泼的是___(填元素符号)。
(2)③的气态氢化物的电子式___,②④形成的气态化合物的结构式___。
(3)这些元素形成的最高价氧化物的水化物中,碱性最强的化合物为___(填物质的化学式),写出它的电子式:___;酸性最强的含氧酸为___(填物质的化学式),写出它的电离方程式:___。
(4)在②和③两种元素中,非金属性较强的是___(填元素名称),②的单质可以和③的最高价氧化物的水化物反应,请写出有关化学方程式___。
(5)②与Si元素分别形成的最高价氧化物,___的熔点更高,原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法错误的是( )
A.1mol的Fe分别与足量的盐酸和稀硫酸反应,电子转移数目均为2NA
B.125gCuSO4·5H2O晶体中含有0.5NA个Cu2+
C.常温常压下,等质量的SO2、S2含有相同的分子数
D.1molNa2O2固体中含原子总数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
(1)某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量CuSO4溶液可加快氢气 的生成速率。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。 请分析氢气生成速率下降的主要原因___________________________。
(2)用甲烷制取氢气的两步反应的能量变化如下图所示,则甲烷和水蒸气反 应生成二 氧化碳和氢气的热化学方程式是___________________________。

(3)科学家最近研究出一种环保,安全的储氢方法,其原理可表示为:NaHCO3 ![]() H2
H2![]() HCOONa
HCOONa ![]() H2O。下列有关说法正确的是_____________。
H2O。下列有关说法正确的是_____________。
A.储氢、释氢过程均无能量变化
B.NaHCO3、HCOONa均具有离子键和共价键
C.储氢过程中,NaHCO3被氧化
D.释氢过程中,每消耗0.1 mol H2O放出2.24 L的H2
(4)Mg2Cu是一种储氢合金。350 ℃时,Mg2Cu与H2反应,生成MgCu2 和仅含一种 金属元素的氢化物(该氢化物中氢的质量分数为0.077)。Mg2Cu与H2反应的化学方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关键环节训练A、B、C、D四物质有如下转化关系(反应条件和部分产物已略去):A![]() B
B![]() C
C![]() D。回答下列问题:
D。回答下列问题:
(1)若A为气态氢化物和D能通过化合反应生成一种盐,则:
①简述检验A气体的方法________;
②写出D制备B的离子方程式_______;
③写出由A生成B的化学方程式_________;
④某同学用干燥的圆底烧瓶收集一瓶A气体,用滴入酚酞的水做喷泉实验,能观察到美丽的红色喷泉。用方程式解释喷泉呈红色的原因____________;
(2)若A与B反应能生成一种淡黄色固体单质。写出B→C的化学方程式__________;
(3)若A是金属单质,C是一种淡黄色固体。写出C的电子式________说出C的一种用途_______。
(4)学法题:结合A![]() B
B![]() C
C![]() D转化关系总结出连续氧化的物质有______(至少写出三组物质)。
D转化关系总结出连续氧化的物质有______(至少写出三组物质)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一氧化碳与氢气可以合成甲醇,反应为CO(g)+2H2(g) ![]() CH3OH(g) △H<0。
CH3OH(g) △H<0。
(1)某温度下,将2 mol CO和6 mol H2充人2 L的密闭容器中,充分反应达到平衡, 测 得c(H2) =2.2 mol·L-1,则CO的转化率为___________。
(2)T1℃时,此反应的平衡常数为K(T1)=50。此温度下,在一个2 L的密闭容器中加入一定量CO和H2,反应到某时刻测得各组分的浓度如下:
物质 | H2 | CO | CH3OH |
浓度/(mol·L-1) | 0.2 | 0.2 | 0.4 |
①比较此时正、逆反应速率的大小:![]() _______
_______![]() 值(填“>”、“<”或“=”)。
值(填“>”、“<”或“=”)。
②若其他条件不变时,只改变反应的某一个条件,下列说法正确的是____________。
A.若达到新平衡时c(CO)=0.3 mo1/L,平衡一定逆向移动
B.若将容器体积缩小到原来的一半,达到新平衡时,0.2 mol/L<c(CO)<0.4 mol/L
C.若向容器中同时加入0.4 mol CO和0.8 mol CH3OH(g),平衡不移动
D.若升高温度,平衡常数将增大
(3)CO2和SO2的处理是许多科学家都在着力研究 的重点。有学者想以如图所示装置用燃料电池原理将 CO2、SO2转化为重要的化工原料。

①若A为CO2,B为H2,C为CH3OH,电池总反应式CO2+3H2 =CH3OH+H2O,则正极反应式为____________。
②若A为SO2,B为O2,C为H2SO4,则负极反应式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳是引起“温室效应”的主要物质,应该减少二氧化碳的排放。
(1)有一种用CO2生产甲醇燃料的方法:
已知:CO2(g)+3H2(g)═CH3OH(g)+H2O(l)△H=-akJmol-1;
CH3OH(g)═CH3OH(l)△H=-bkJmol-1;
2H2(g)+O2(g)═2H2O(l)△H=-ckJmol-1;
则表示CH3OH(l)燃烧热的热化学方程式为:__________________________________________。
(2)在一定温度下的2L固定容积的密闭容器中,通入2mol CO2和3molH2,发生的反应为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H<0,测得CO2(g)和CH3OH(g)的浓度随时间变化如右图所示。
CH3OH(g)+H2O(g)△H<0,测得CO2(g)和CH3OH(g)的浓度随时间变化如右图所示。

①从0min到10min,v(H2)=_____________。
②下列措施中能使![]() 增大的是______(选填编号)。
增大的是______(选填编号)。
A.升高温度 B.恒温恒容下充入He(g)
C.将H2O(g)从体系中分离 D.恒温恒容再充入2molCO2和3molH2
③计算该温度下此反应的平衡常数K=____________(填分数或保留两位有效数字)。若改变_________条件(填编号),可使K=1。
A.增大压强B.增大反应物浓度C.降低温度D.升高温度 E.加入催化剂
(3)某甲醇燃料电池原理如图所示

①则M区发生的电极反应式为_______________________________。
②用上述电池做电源,用图2装置电解饱和食盐水(电极均为惰性电极).则该电解反应的总反应的离子方程式为:____________________________。
假设溶液体积为300mL,当溶液的pH值为13时(在室温下测定),理论上消耗甲醇的质量为________________(忽略溶液体积变化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸、醋酸和碳酸是化学实验和研究中常用的几种酸。已知室温下:Ka(CH3COOH)=1.7×10-5 mol·L-1;H2CO3的电离常数Ka1=4.2×10-7mol·L-1、Ka2=5.6×10-11mol·L-1。
(1)①请用离子方程式解释碳酸氢钠水溶液显碱性的原因________________。
②常温下,物质的量浓度相同的下列四种溶液:a、碳酸钠溶液 b、醋酸钠溶液 c、氢氧化钠溶液 d、氢氧化钡溶液。其pH由大到小的顺序是:_____(填序号)。
(2)某温度下,pH均为4的盐酸和醋酸溶液分别加水稀释,其pH随溶液体积变化的曲线图中a、b、c三点对应的溶液中水的电离程度由大到小的顺序是_______;该醋酸溶液稀释过程中,下列各量一定变小的是______________。

a.c(H+) b.c(OH-)
c.![]() d.
d.![]()
(3)在t℃时,某NaOH稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=12,则:
①该温度下水的离子积常数Kw=___________mol2·L-2。
②在该温度下,将100mL0.1 mol·L-1的稀H2SO4与100mL0.4 mol·L-1的NaOH溶液混合后,溶液的pH= _____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com