
| 1 |
| 2 |
 ,其氢化物为其结构与氨气相似,所以其氢化物是极性分子,由于NH3分子中存在氢键,而AsH3中不存在氢键,故AsH3的沸点低于NH3,
,其氢化物为其结构与氨气相似,所以其氢化物是极性分子,由于NH3分子中存在氢键,而AsH3中不存在氢键,故AsH3的沸点低于NH3, ;极性;NH3分子中存在氢键,而AsH3中不存在氢键;
;极性;NH3分子中存在氢键,而AsH3中不存在氢键;

 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
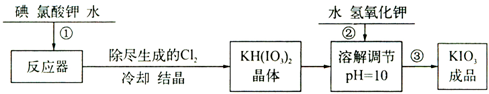
| 温度/℃ | 20 | 40 | 60 | 80 |
| KIO3/100g水 | 8.08 | 12.6 | 18.3 | 24.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHSO4═Na++H++SO42- |
| B、NaHCO3═Na++H++CO32- |
| C、MgCl2═Mg2++2Cl- |
| D、Ba(OH)2═Ba2++2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、丙烷和丁烷均属于烷烃 |
| B、两者分子中均含有碳碳双键 |
| C、丙烷和丁烷燃烧均是放热反应 |
| D、丙烷和丁烷充分燃烧均生成二氧化碳和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、至少存在4种离子 |
| B、Clˉ一定存在,且c(Clˉ)=0.4mol?L-1 |
| C、SO42ˉ、NH4+一定存在,AlO2-可能存在 |
| D、CO32ˉ、Al3+一定不存在,K+可能存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质(括号内为杂质) | 除杂方法 | |
| A | CO2(O2) | 灼热的铜网 |
| B | FeCl2溶液(CuCl2) | 加入过量铁粉,过滤 |
| C | CaCl2溶液(盐酸) | 加入过量CaCO3,过滤 |
| D | CO2(CO) | 通入O2 点燃 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C(s)+O2(g)=CO2(g);△H=-315kJ |
| B、NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);△H=-57.3kJ?mol-1 |
| C、C2H5OH+3O2=2CO2+3H2O;△H=-1368.8kJ?mol-1 |
| D、2H2O(g)=2H2(g)+O2(g);△H=-483.6kJ?mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com