
【题目】根据![]() 时某些物质的溶解度
时某些物质的溶解度![]() 数据:
数据:
|
|
|
|
|
|
|
|
下列说法不正确的是( )
A.碳酸镁悬浊液中存在![]()
![]()
![]()
B.用![]() 溶液浸泡锅炉中的水垢,可将水垢中的
溶液浸泡锅炉中的水垢,可将水垢中的![]() 转化为
转化为![]()
C.向![]() 悬浊液中滴加
悬浊液中滴加![]() ,沉淀变为红褐色,说明溶解度
,沉淀变为红褐色,说明溶解度![]()
D.向2mL饱和![]() 溶液中先后滴加
溶液中先后滴加![]() 的
的![]() 、NaOH溶液各2滴,产生的白色沉淀只有
、NaOH溶液各2滴,产生的白色沉淀只有![]()
【答案】D
【解析】
A、碳酸镁悬浊液是碳酸镁的饱和溶液,存在溶解平衡,其溶解平衡的表达式为:![]() ,选项A正确;
,选项A正确;
B、根据Ksp可知,![]() 的溶解度大于
的溶解度大于![]() 的溶解度,而沉淀容易由溶解度大的向溶解度小的转化,故用
的溶解度,而沉淀容易由溶解度大的向溶解度小的转化,故用![]() 溶液浸泡锅炉中的水垢,可将水垢中的
溶液浸泡锅炉中的水垢,可将水垢中的![]() 转化为
转化为![]() ,选项B正确;
,选项B正确;
C、沉淀容易由溶解度大的向溶解度小的转化,向![]() 悬浊液中滴加
悬浊液中滴加![]() ,沉淀变为红褐色,即
,沉淀变为红褐色,即![]() 转化为
转化为![]() 沉淀,则说明溶解度
沉淀,则说明溶解度![]() ,选项C正确;
,选项C正确;
D、设产生![]() 沉淀时所需的碳酸根的浓度为
沉淀时所需的碳酸根的浓度为![]() ,产生
,产生![]() 沉淀是所需的氢氧根的浓度为
沉淀是所需的氢氧根的浓度为![]() ,根据
,根据![]() 的Ksp可知:
的Ksp可知:![]() ,根据
,根据![]() 的Ksp可知:
的Ksp可知:![]() ,即当同时产生
,即当同时产生![]() 和
和![]() 沉淀时,所需的碳酸根和氢氧根的浓度之比为:
沉淀时,所需的碳酸根和氢氧根的浓度之比为: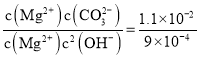 ,则
,则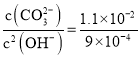 ,
, :3,故产生
:3,故产生![]() 沉淀所需的氢氧根的浓度比产生
沉淀所需的氢氧根的浓度比产生![]() 沉淀所需的碳酸根的浓度更高,故应先产生产生
沉淀所需的碳酸根的浓度更高,故应先产生产生![]() 沉淀,选项D错误。
沉淀,选项D错误。
答案选D。


科目:高中化学 来源: 题型:
【题目】实验测得 0.5mlL-1CH3COONa 溶液和 H2O 的 pH 随温度变化的曲线如图所示。下用说法正确的是
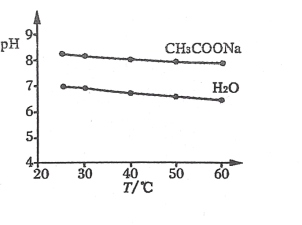
A.随温度升高,CH3COONa 溶液的 c(OH-)增大
B.随温度升高,H2O 的 pH 逐渐减小,是因为水中c(H+)>c(OH-)
C.随温度升高,CH3COONa 溶液的 pH 变化是 Kw 改变不大和水解平衡移动共同作用的结果
D.随温度升高, CH3COONa 溶液的 pH 降低是因为 CH3COO-水解平衡向逆反应方向移动的结果
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是

A. 分子中含有2种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C. 1mol分枝酸最多可与3molNaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,已知某三元弱酸H3A的三级电离平衡常数分别为![]() 、
、![]() 、
、![]() ,下列说法错误的是
,下列说法错误的是
A.Na3A的第一级水解平衡常数Kh1的数量级为10-2
B.在NaH2A溶液中:![]()
C.0.1mol/L的Na3A和0.1mol/L的Na2HA溶液中水电离程度,前者大于后者
D.向H3A溶液中加入NaOH溶液至中性时:c(Na+)=3c(A3-)+2c(HA2-)+c(H2A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验原理、现象、结论均正确的是( )
A. 图中滴加乙醇,试管中橙色溶液变为绿色,说明
图中滴加乙醇,试管中橙色溶液变为绿色,说明![]() 被还原成
被还原成![]()
B. 图中,右边试管中产生气泡迅速,说明氯化铁的催化效果比二氧化锰好
图中,右边试管中产生气泡迅速,说明氯化铁的催化效果比二氧化锰好
C. 图中,由试管中收集到的无色气体,证明铜与稀硝酸的反应产物是NO
图中,由试管中收集到的无色气体,证明铜与稀硝酸的反应产物是NO
D. 图中,试管中先出现白色沉淀、加
图中,试管中先出现白色沉淀、加![]() 后产生黑色沉淀,但不能验证AgCl的溶解度大于
后产生黑色沉淀,但不能验证AgCl的溶解度大于![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取1 mol A和a mol B使其发生反应A(g)+aB(g)![]() bC(g),当反应达到平衡时,A的转化率为50%,在同温、同压下测得混合气体的密度是原来的
bC(g),当反应达到平衡时,A的转化率为50%,在同温、同压下测得混合气体的密度是原来的![]() 倍,则a、b可能是( )
倍,则a、b可能是( )
A.a=1,b=4B.a=3,b=3
C.a=2,b=3D.a=3,b=2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用钛白粉厂废酸(主要含硫酸、Fe3+、Fe2+、TiO2+、Al3+)制备过二硫酸铵[(NH4)2S2O8],同时回收TiO(OH)2的简要流程如下:
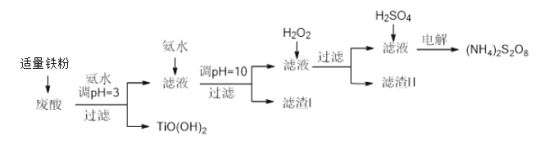
已知:i.部分离子完全生成氢氧化物沉淀的pH:
金属离子 | TiO2+ | Fe3+ | Fe2+ | Al3+ |
开始沉淀的PH | 1.2 | 1.9 | 7.0 | 3.2 |
沉淀完全的pH | 2.8 | 3.1 | 9.4 | 4.7 |
ii.pH>7时,Fe2+部分生成Fe(II)氨络离子[Fe(NH3)2]2+。
请回答下列问题:
(1)加入适量铁的作用是________________________。
(2)生成TiO(OH)2的化学方程式是____________________。
(3)滤渣I、滤渣Ⅱ中均含有的物质的化学式是________
(4)加入H2O2的目的是氧化除掉Fe(II)氨络离子[Fe(NH3)2]2+,配平下列离子方程式:2[Fe(NH3)2]2++____________+4H2O +H2O2=___________+ 4NH3·H2O。
(5)常温下,电解液中含硫微粒主要存在形式与pH的关系如下图所示。
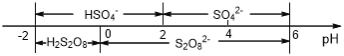
在阳极放电的离子主要为HSO4-,阳极区电解质溶液的pH范围为_________
(6)已知Ksp[Al(OH)3]=3.2×10-34 ,当pH=10 时,求溶液中c(Al3+)=___________
(7)25℃,pH=3的(NH4)2SO4溶液中,计算2c(SO42-)- c(NH4+) =___________(列式即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对分子的性质的解释中,不正确的是
A.HCl、Cl2与H2分子中均含有σ键,且σ键为轴对称
B.碘易溶于四氯化碳,甲烷难溶于水都可用“相似相溶”原理解释
C.配合物Fe(CO)n内中心原子价电子数与配体提供电子总数之和为18,则n=5
D.水光卤气(COCl2)、甲醛分子的立体构型和键角均完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素 X、Y、Z 组成的化合物 Y2X 和 ZX2。Y2X 溶于水形成的溶液能与 ZX2 反应生成一种化合物 Y2ZX3。已知三种元素原子的质子总数为 25,且 Z 和 Y 的原子序数之和比 X 的 原子序数2倍还多 1,Z 原子有2个电子层,最外层电子数是核外电子数的 2/3 倍,试回答:
(1)Y 元素在元素周期表中的位置_____。
(2)Y2X 对应水化物的电子式_____。
(3)X 的氢化物比同主族的氢化物的熔沸点明显偏高的原因_____。
(4)X、Y 两种元素还可以形成除 Y2X 之外的另一种化合物,试用电子式表示该物质的形成 过程_________,该化合物与 1mol ZX2完全反应,则反应中电子转移的数目 为_____。(用 NA表示阿伏加德罗常数的值)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com