
| A、福尔马林 | B、银氨溶液 |
| C、葡萄糖 | D、蔗糖 |
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案科目:高中化学 来源: 题型:
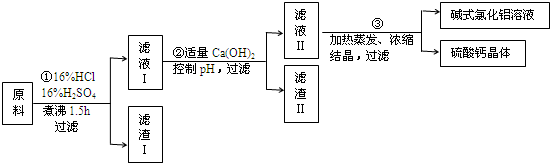
查看答案和解析>>
科目:高中化学 来源: 题型:

| c(H2)c(CO) |
| c(H2O) |
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、天然蛋白质水解的最终产物是多种α-氨基酸 |
| B、所有蛋白质遇到硝酸后加热都会变黄 |
| C、蛋白质盐析是可逆的物理过程,利用该性质可提纯和分离蛋白质 |
| D、肥皂液、淀粉液、蛋白质溶液都可以产生丁达尔现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| O2 |
| H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
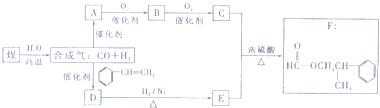
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、6mol | B、3mol |
| C、4mol | D、5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
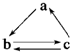 下列所列各组物质中,物质之间通过一步反应就能实现如图转化的是( )
下列所列各组物质中,物质之间通过一步反应就能实现如图转化的是( )| a | b | c | |
| A | Al | AlCl3 | Al(OH)3 |
| B | CO2 | Na2CO3 | NaHCO3 |
| C | Si | SiO2 | H2SiO3 |
| D | CH2═CH2 | CH3CH2OH | CH3CHO |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com