

| c(H2)c(CO) |
| c(H2O) |
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
 2NH3或NH3+HNO3═NH4NO3;
2NH3或NH3+HNO3═NH4NO3; CO(g)+H2(g),故答案为:C(s)+H2O(g)
CO(g)+H2(g),故答案为:C(s)+H2O(g) CO(g)+H2(g);
CO(g)+H2(g);| c 2(CO) |
| c(CO 2) |
| c(H 2)×c(CO 2) |
| c(CO)×c(H 2O) |
| c(CO)×c(H2) |
| c(H 2O) |
| c(H 2)×c(CO 2) |
| c(CO)×c(H 2O) |
| c 2(CO) |
| c(CO 2) |
| c(CO)×c(H2) |
| c(H 2O) |
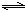 H2(g)+CO2(g),
H2(g)+CO2(g),| x?x |
| (0.020-x)?(0.020-x) |
| 0.015 |
| 0.02 |


 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
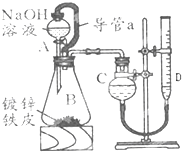 “白铁皮”即镀锌铁皮,镀锌层犹如铁皮的保护层,具有较强的耐腐蚀性,这层膜的厚度是判断白铁皮质量的重要指标,某研究性学习小组为了测定镀膜厚度,设计了下面的实验方案.
“白铁皮”即镀锌铁皮,镀锌层犹如铁皮的保护层,具有较强的耐腐蚀性,这层膜的厚度是判断白铁皮质量的重要指标,某研究性学习小组为了测定镀膜厚度,设计了下面的实验方案.查看答案和解析>>
科目:高中化学 来源: 题型:
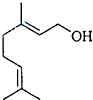
| A、香叶醇的分子式为C10H20O |
| B、不能使溴的四氯化碳溶液褪色 |
| C、不能发生催化氧化反应生成醛 |
| D、既能发生加成反应又能发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、a=-23.1kJα=40% |
| B、a=-23.1kJ α=25% |
| C、a=+23.1kJα=40% |
| D、a=+23.1kJ α=25% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3OH |
| B、C2H5OH |
| C、C3H7OH |
| D、C4H9OH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | a | 1×10-12 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com