
下列有关实验的现象描述正确的是
A.氢气在氯气中燃烧,火焰呈苍白色,瓶口出现大量白雾
B.磷在氯气中燃烧,发出明亮的蓝紫色火焰,产生大 量白色烟雾
量白色烟雾
C.铜在氯气中燃烧,产生白烟,加水溶解后可得蓝绿色溶液
D.用洁净的铂丝沾取碳酸钾粉末在酒精灯火焰上灼烧,可观察到明亮的紫色火焰
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源:2016届福建省福州市高三上学期第二次质量检测考试化学试卷(解析版) 题型:选择题
向密闭容器中充入物质的量浓度均为 0.1 mol/L的CH4 和 CO2,在一定条件下发生反应CH4(g)+CO2(g) 2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图所示。下列说法不正确的是
2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图所示。下列说法不正确的是

A.平衡时CO与H2的物质的量比为1:1
B.p1、p2、p3、p4由大到小的顺序为p1<p2<p3<p4
C.1100℃,p4条件下,该反应10 min时达到平衡点X,则ν(CO2) = 0.008 mol•L-1•min-1
D.随着温度升高,该反应的平衡常数减小
查看答案和解析>>
科目:高中化学 来源:2016届河北省高三上学期二调化学试卷(解析版) 题型:选择题
室温下,下列各组离子能大量共存的是
A.稀硫酸中:K+、Mg2+、AlO2-、S2O32-
B.Na2S溶液中:SO42-、K+、Cl-、Cu2+
C.Kw/c(H+)=10-13溶液中:Fe3+、NH4+ 、Mg2+、SO42-
D.通人大量CO2的溶液中:Na+、ClO-、CH3COO-、HCO3-
查看答案和解析>>
科目:高中化学 来源:2016届河南省高三第四次大考化学试卷(解析版) 题型:选择题
已知NA代表阿伏加德罗常数,下列说法正确的是
A.在1 L 0.1 mol·L-1氟化钠溶液中含有F-和HF数目之和为0.1NA
B.300 mL 2 mol/L蔗糖溶液中所含分子数为0.6NA
C.标准状况下,1.8gD2O中含有NA个中子
D.标准状况下,2.24 L三氯甲烷中含有氯原子数目为0.3NA
查看答案和解析>>
科目:高中化学 来源:2016届河北省衡水市高三复习班上月考化学试卷(解析版) 题型:选择题
工业上将Na2CO3和Na2S以1:2的物质的量之比配成溶液,再通入SO2,可制取Na2S2O3,同时放出CO2。在该反应中
A.二氧化硫体现还原性,做还原剂
B.氧化剂与还原剂的物质的量之比为1:2
C.每生成1molNa2S2O3,转移4mol电子
D.相同条件下,每吸收10m3SO2就会放出2.5m3CO2
查看答案和解析>>
科目:高中化学 来源:2016届甘肃省高三9月月考化学试卷(解析版) 题型:填空题
(10分)常见的五种盐X、Y、Z、M、N,它们的阴离子可能是SO42-、Cl-、NO3-、CO32-,阳离子可能是Ag+、NH4+、Na+、Al3+、Cu2+、Ba 2+、Fe3+,已知:
2+、Fe3+,已知:
①M的焰色反应呈黄色。
②五种盐均溶于水,水溶液均为无色。
③X的溶液呈中性,Y、Z、N的溶液呈酸性,M的溶液呈碱性。
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有X、Z的溶液不产生沉淀。
⑤若在这五种盐的溶液中,分别加入氨水,N和Z的溶 液中生成沉淀,继续加氨水,Z中沉淀消失。
液中生成沉淀,继续加氨水,Z中沉淀消失。
⑥把X的溶液分别加入到Y、Z、N的溶液中,均能生成不溶于稀硝酸的沉淀。
请回答下列问题:
(1)五种盐中,所含阴离子相同的两种盐的化学式是__________________
(2)M溶液显碱性的原因是(用离子方程式表示)___________ __________
(3)X和Z的溶液反应的离子方程式是____________________
(4)N和氨水反应的离子方程式是__________________
(5)若要检验Y中所含的阳离子,正确的实验方法是_________________
查看答案和解析>>
科目:高中化学 来源:2016届甘肃省高三9月月考化学试卷(解析版) 题型:选择题
人们习惯上把金、银、铜、铁、锡五种金 属统称为“五金”。在“五金”顺序中,把一种金属的位置向后移一位,正好符合某化学规律。这种金属和该化学规律是
属统称为“五金”。在“五金”顺序中,把一种金属的位置向后移一位,正好符合某化学规律。这种金属和该化学规律是
A.铁、金属活动性顺序表 B.金、质量守恒定律
C.银、元素周期律 D.铜、金属密度顺序表
查看答案和解析>>
科目:高中化学 来源:2016届河南省高三上学期开学考试化学试卷(解析版) 题型:填空题
(12分)用NH3催化还原NxOy可以消除氮氧化物的污染。
已知:反应I: 4NH3(g)+6NO(g)  5N2(g)+6H2O(l) △H1
5N2(g)+6H2O(l) △H1
反应II: 2NO(g)+O2(g)  2NO2(g) △H2 (且|△H1| =2|△H2|)
2NO2(g) △H2 (且|△H1| =2|△H2|)
反应III:4NH3(g)+6NO2(g)  5N2(g)+3O2(g)+6H2O(l) △H3
5N2(g)+3O2(g)+6H2O(l) △H3
反应I和反应II在不同温度时的平衡常数及其大小关系如下表
温度/K | 反应I | 反应II | 已知: |
298 | K1 | K2 | |
398 | K1′ | K2′ |
(1)△H3 = (用△H1、△H2 的代数式表示);推测反应III是 反应(填“吸热”或“放热”)
(2)相同条件下,反应I在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图所示。

①计算0~4分钟在A催化剂作用下,反应速率v(NO)= 。
②下列说法不正确的是 。
A.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
B.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
C.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
D.增大压强能使反应速率加快,是因为增加了活化分子百分数
(3)一定条件下,反应II达到平衡时体系中n(NO)∶n(O2)∶n(NO2)=2∶1∶2。恒温恒压时,在其它条件不变时,再充入NO2气体, NO2体积分数 (填“变大”、“变小”或“不变”)
(4)电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下,溶液中OH-向电极 移动(填a或b),负极的电极反应式为 。
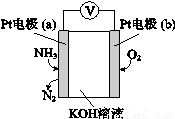
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省扶余市高一上学期第一次月考化学试卷(解析版) 题型:选择题
在5L物质的量浓度为2mol/l的K2SO4溶液中K+的物质的量浓度为
A.2mol/l B.4mol/l C.1 mol/l D.20mol/l
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com