
【题目】元素周期表中大多数元素是金属元素,金属及其化合物在生活生产中有着重要应用,根据试题信息,完成下列计算:
(1)某常见二价金属12.6g与足量稀硫酸反应,生成氢气5.04L(S.T.P),该元素原子的摩尔质量为__g/mol.
(2)39.32g某金属混合物,由12.32g镁和0.25mol另一种比镁不活泼的金属元素A组成,该混合物与一定量盐酸反应,产生氢气4.928L(S.T.P),则参加反应的HCl为__mol,金属A的相对原子质量为__.
(3)由NaCl、NaHCO3、Na2CO310H2O组成的混合物157.8g,充分加热后,产生的气体(气体温度150℃)依次通过无水CaCl2和碱石灰,两种吸收剂分别增重59.4g和13.2g,则混合物中NaHCO3的质量分数为___,若等质量的该混合物与足量盐酸反应,产生二氧化碳(S.T.P)__L.
【答案】56 0.44 108 31.94% 20.16
【解析】
(1)、设出金属的摩尔质量为M,表示出金属的物质的量,然后根据化学方程式中的计量关系来计算;
(2)、根据2HCl~H2来分析消耗盐酸的量;根据该金属的质量等于混合物的质量减去镁的质量,根据摩尔质量M=![]() 来求算;
来求算;
(3)、根据对混合物NaCl、NaHCO3、Na2CO310H2O加热时,NaHCO3分解:2NaHCO3![]() Na2CO3+CO2↑+H2O;Na2CO310H2O
Na2CO3+CO2↑+H2O;Na2CO310H2O![]() Na2CO3+10H2O,故无水CaCl2增重的是水的质量,碱石灰增重的是二氧化碳的质量,据此分析。
Na2CO3+10H2O,故无水CaCl2增重的是水的质量,碱石灰增重的是二氧化碳的质量,据此分析。
(1)、设金属的摩尔质量为M,则12.6g金属的物质的量n=![]() =
=![]() mol,生成氢气5.04L,物质的量n=
mol,生成氢气5.04L,物质的量n=![]() =0.225mol,由于金属为+2价,故1mol金属生成1mol氢气,化学方程式中的计量关系可知:
=0.225mol,由于金属为+2价,故1mol金属生成1mol氢气,化学方程式中的计量关系可知:![]() =0.225解得M=56,故答案为:56;
=0.225解得M=56,故答案为:56;
(2)、由于产生氢气4.928L(S.T.P),故氢气的物质的量n=![]() =
=![]() =0.22mol,而根据在反应中:2HCl~H2,可知消耗盐酸的量为0.44mol;该金属的质量等于混合物的质量减去镁的质量,即m=39.32g﹣12.32g=27g,而摩尔质量M=
=0.22mol,而根据在反应中:2HCl~H2,可知消耗盐酸的量为0.44mol;该金属的质量等于混合物的质量减去镁的质量,即m=39.32g﹣12.32g=27g,而摩尔质量M=![]() =
=![]() =108g/mol,故相对分子质量为108,故答案为:0.44,108;
=108g/mol,故相对分子质量为108,故答案为:0.44,108;
(3)、根据对混合物NaCl、NaHCO3、Na2CO310H2O加热时,NaHCO3分解:2NaHCO3![]() Na2CO3+CO2↑+H2O;Na2CO310H2O
Na2CO3+CO2↑+H2O;Na2CO310H2O![]() Na2CO3+10H2O,故无水CaCl2增重的59.4g是水的质量,物质的量n=
Na2CO3+10H2O,故无水CaCl2增重的59.4g是水的质量,物质的量n=![]() =
=![]() =3.3mol;碱石灰增重的13.2g是二氧化碳的质量,物质的量n=
=3.3mol;碱石灰增重的13.2g是二氧化碳的质量,物质的量n=![]() =0.3mol,根据NaHCO3分解反应可知:2NaHCO3
=0.3mol,根据NaHCO3分解反应可知:2NaHCO3![]() Na2CO3+CO2↑+H2O,NaHCO3的物质的量为0.6mol,质量为50.4g,故在混合物中的质量分数=
Na2CO3+CO2↑+H2O,NaHCO3的物质的量为0.6mol,质量为50.4g,故在混合物中的质量分数=![]() ×100%=31.94%;
×100%=31.94%;
NaHCO3的物质的量为0.6mol,分解时生成的水为0.3mol,而水的物质的量共为3.3mol,故由Na2CO310H2O分解生成的水的物质的量为3mol,根据
Na2CO310H2O![]() Na2CO3+10H2O可知,Na2CO310H2O的物质的量为0.3mol,与盐酸反应时,生成二氧化碳的物质的量为n=0.6mol+0.3mol=0.9mol,
Na2CO3+10H2O可知,Na2CO310H2O的物质的量为0.3mol,与盐酸反应时,生成二氧化碳的物质的量为n=0.6mol+0.3mol=0.9mol,
在标况下的体积V=nVm=0.9mol×22.4L/mol=20.16L,故答案为:31.94%; 20.16L。


科目:高中化学 来源: 题型:
【题目】2016年中国科学家成功合成NiO/TiO2电解水催化剂和新型高效的钙钛矿太阳能电池,为解决能源危机保护环境作出了重大贡献。请回答下列问题:
(1)TiO2与焦炭、Cl2在高温下反应的化学方程式为:TiO2+2C+2Cl2 ![]() TiCl4+2CO。
TiCl4+2CO。
①基态钛原子的价电子排布式为_________________。
②该反应中涉及到的非金属元素的电负性大小顺序为_______________________。
(2)已知NiO/TiO2催化化合物甲生成化合物乙的过程如图所示:

化合物甲的沸点小于化合物乙的沸点,主要原因是___________________。在化合物乙中,氧原子的杂化方式是______________。
(3)CH3NH3+、Ti4+、Pb2+、Cl-等离子是组成新型钙钛矿太阳能电池的主要离子。CH3NH3+离子中H—N—H键的键角比NH3分子中H—N—H键的键角 ______ (填“大”或“小”),原因是_____________ 。
(4)Sb(锑)和Ga(镓)的卤化物有很多用途。一定条件下将SbCl3与GaCl3以物质的量之比为l:l反应得到一种固态离子化合物,有人提出了以下两种结构。你认为下列关于结构和说法中合理的是 ____ 。
a. [SbCl2+][GaCl4-] b. [GaCl2+][SbCl4-] c. 没有相关资料,无法判断
(5)金属钛晶胞(如图1所示)中有若干个正四面体空隙,图1中a、b、c、d四个钛原子形成的正四面体其内部空隙中可以填充其他原子。
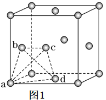
①请回答,金属钛晶胞的结构属于____________。
a. 简单立方 b. 体心立方 c. 面心立方 d. 金刚石型
②若晶胞中所有的正四面体空隙中都填充氢原子,那么形成的氢化钛的化学式为______________。
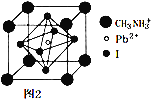
(6)某钙钛矿太阳能电池材料的晶胞如图2所示,其晶胞参数为d pm、密度为ρ g·cm-3。则该晶体的摩尔质量________ g·mol-1。(用含d、ρ等符号的式子表示,用NA表示阿伏加德罗常数的值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法中正确的是()
A.Ksp(AB2)<Ksp(CD),说明AB2的溶解度小于CD的溶解度
B.在ZnS的沉淀溶解平衡体系中加入蒸馏水,ZnS的Ksp增大
C.AgCl分别在同浓度的CaCl2溶液和NaCl溶液中溶解度不同
D.在CaCO3的沉淀溶解平衡体系中加入稀盐酸,沉淀溶解平衡不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香化合物A(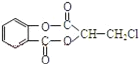 )在一定条件下可以发生如图所示的转化(其他产物和水已略去)。
)在一定条件下可以发生如图所示的转化(其他产物和水已略去)。
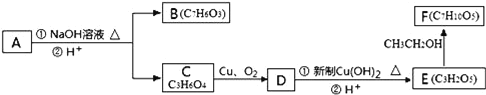
请回答下列问题:
(1)请写出A中包含的官能团的名称:__。
(2)有机物C可以由乳酸经过几步有机反应制得,其中最佳的次序是__。
A.消去、加成、水解、酸化 B.氧化、加成、水解、酸化
C.取代、水解、氧化、酸化 D.消去、加成、水解、氧化
(3)写出由E制得F的化学方程式:__。
(4)1molA在氢氧化钠溶液中加热,充分反应消耗氢氧化钠__mol,写出该反应的化学方程式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)第三周期元素的原子所形成的简单离子中:半径最大的阴离子是__;氧化性最强的阳离子是__.
(2)下列事实可以作为S和Cl非金属性强弱的判断依据的是__(选填序号)
a.Cl的最高正价比S高 b.可用浓H2SO4制HCl
c.HCl的酸性比H2S强 d.Cl2与H2S反应生成S.
(3)硅元素最外层有__种能量不同的电子;SiCl4的空间构型和CH4相同,写出SiCl4的电子式:__.
(4)PH3和NH3的某些化学性质相似.下列对晶体PH4I性质的推测,错误的是__(选填序号)
a.PH4I是一种共价化合物 b.PH4I能与烧碱溶液反应
c.PH4I加热后会发生升华 d.PH4I溶液能与溴水反应.
(5)二氯化二硫(S2C12)可用作橡胶工业的硫化剂,它的分子结构与H2O2相似.下列有关说法不正确的是__(选填序号)
a.S2C12分子中有4对共用电子对
b.S2C12分子中没有非极性键
c.S2C12分子中,S为+1价,Cl为﹣1价
d.S2C12分子中各原子均为8电子稳定结构.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①在稀碱溶液中,溴苯难发生水解
②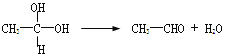
③苯酚与浓溴水反应,只有邻、对位上的氢被取代
现有分子式为C10H10O2Br2的芳香族化合物X,其苯环上有四个取代基且苯环上的一溴代物只有一种,其在一定条件下可发生下述一系列反应,其中C能发生银镜反应,E遇FeCl3溶液显色且能与浓溴水反应。
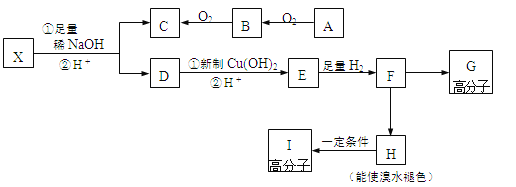
请完成下列填空:
47、写出B的电子式________;F→H的反应类型是________反应。
48、写出A→B的化学方程式_________________________。
49、X的结构简式为__________。
50、下列关于E的描述正确的是___(选填序号)
a.能发生酯化反应 b.含有4种不同化学环境的氢原子
c.与C互为同系物 d.1mol E最多能与2mol NaHCO3作用
51、写出F→G的化学方程式:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中:①甲苯②聚异戊二烯③汽油④![]() ⑤聚乙烯⑥
⑤聚乙烯⑥![]() ,⑦丁子香酚
,⑦丁子香酚 ,根据题意,填写序号.
,根据题意,填写序号.
(1)既能使溴水褪色,也能使酸性高锰酸钾褪色的烃是__.
(2)能和碳酸氢钠反应的是__,写出它与碳酸氢钠反应的方程式__.
(3)写出⑥与足量氢氧化钠溶液共热反应的方程式__.
(4)丁子香酚不具有的性质是__(填序号);
A.易溶于水 B.通常状况下呈固态
C.可发生消去反应 D.遇FeCl3溶液显紫色.
(5)丁子香酚有多种同分异构体,写出符合下列要求的两个同分异构体的结构简式:__等.
①苯环上的一氯取代物为两种; ②遇FeCl3溶液显色; ③能发生银镜反应.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某废液阳离子只可能含有:Na+、NH4+、Ba2+、Cu2+、Fe2+、Fe3+、Al3+中的某几种,实验设计了下述方案进行处理,以回收金属,保护环境
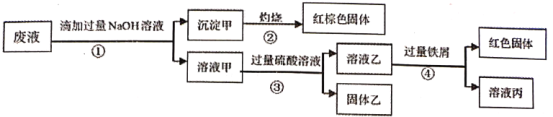
已知:步骤①中,滴加NaOH溶液过程中产生的沉淀会部分溶解,下列说法正确的是:
A.根据步骤①中的现象,说明废液中一定含有Al3+
B.步骤②,由红棕色固体可知,废液中一定存在Fe3+
C.取溶液丙进行焰色反应,焰色为黄色,说明原溶液中一定含Na+
D.该废液一定含有NH4+、Ba2+、Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘在地壳中主要以NaIO3的形式存在,在海水中主要以I的形式存在,几种粒子之间的转化关系如图所示。已知淀粉遇单质碘变蓝,下列说法中正确的是
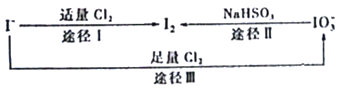
A. 向含I的溶液中通入Cl2,所得溶液加入淀粉溶液一定变蓝
B. 途径II中若生成1 mol I2,消耗1 mol NaHSO3
C. 氧化性的强弱顺序为Cl2>I2>IO3
D. 一定条件下,I与IO3可能生成I2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com