
【题目】芳香化合物A(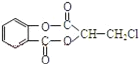 )在一定条件下可以发生如图所示的转化(其他产物和水已略去)。
)在一定条件下可以发生如图所示的转化(其他产物和水已略去)。
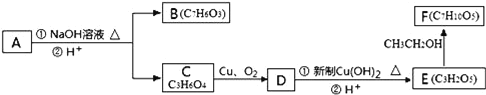
请回答下列问题:
(1)请写出A中包含的官能团的名称:__。
(2)有机物C可以由乳酸经过几步有机反应制得,其中最佳的次序是__。
A.消去、加成、水解、酸化 B.氧化、加成、水解、酸化
C.取代、水解、氧化、酸化 D.消去、加成、水解、氧化
(3)写出由E制得F的化学方程式:__。
(4)1molA在氢氧化钠溶液中加热,充分反应消耗氢氧化钠__mol,写出该反应的化学方程式:__。
【答案】酯基、氯原子 A ![]() +2CH3CH2OH
+2CH3CH2OH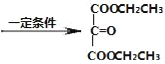 +2H2O 4
+2H2O 4 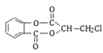 +4NaOH
+4NaOH![]() +NaCl+H2O
+NaCl+H2O
【解析】
A为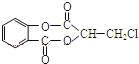 ,在氢氧化钠水溶液条件下发生水解反应、酸化得到B与C,结合B、C分子式可知,B为
,在氢氧化钠水溶液条件下发生水解反应、酸化得到B与C,结合B、C分子式可知,B为![]() ,C为HOCH2CH(OH)COOH,由转化关系可知,D为
,C为HOCH2CH(OH)COOH,由转化关系可知,D为![]() ,E为
,E为![]() ,E与乙醇发生转化反应得到F为
,E与乙醇发生转化反应得到F为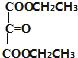 ,据此解答。
,据此解答。
(1)由A的结构简式可知,A中包含的官能团有:酯基、氯原子;
(2)有机物C为HOCH2CH(OH)COOH,可以由乳酸先发生消去反应,再与溴发生加成反应,再在氢氧化钠水溶液、加热条件下发生水解反应,最后酸化得到,故答案选A;
(3)由E制得F的化学方程式为:![]() +2CH3CH2OH
+2CH3CH2OH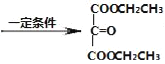 +2H2O;
+2H2O;
(4)A在氢氧化钠水溶液、加热条件下发生为: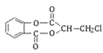 +4NaOH
+4NaOH![]() +NaCl+H2O,1mol A在氢氧化钠溶液中加热,充分反应消耗氢氧化钠4mol。
+NaCl+H2O,1mol A在氢氧化钠溶液中加热,充分反应消耗氢氧化钠4mol。


科目:高中化学 来源: 题型:
【题目】由下列实验现象一定能得出相应结论的是
选项 | A | B | C | D |
装置或操作 | 取两支试管各加入4 mL 0.01 mol/L的草酸溶液,分别滴加2 mL 0.1 mol/L、0.2 mol/L的高锰酸钾溶液 |
|
| 向分别盛有5 mL 0.1 mol/L的硫代硫酸钠溶液的试管中滴加5 mL 0.1 mo/L的硫酸溶液,一段时间后,分别放在冷水和热水中。 |
现象 | 褪色并观察褪色的时间 | 左边棉球变黄,右边棉球变蓝 | 试管中先出现淡黄色固体,后出现黄色固体 | 试管中液体变浑浊且热水中首先出现浑浊 |
结论 | 其他条件不变时,反应物浓度越大,反应速率越快 | 氧化性:Cl2>Br2>I2 | 溶解度:AgCl>AgBr>AgI | 不能说明温度越高,速率越快 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】700℃时,H2(g)+CO2(g)![]() H2O(g)+CO(g)。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2和CO2,起始浓度如下表所示。其中甲经2min达平衡时,v(H2O)为0.025 mol/(L·min),下列判断不正确的是()
H2O(g)+CO(g)。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2和CO2,起始浓度如下表所示。其中甲经2min达平衡时,v(H2O)为0.025 mol/(L·min),下列判断不正确的是()
起始浓度 | 甲 | 乙 | 丙 |
C(H2)/mol/L | 0.1 | 0.2 | 0.2 |
C(CO2)/mol/L | 0.1 | 0.1 | 0.2 |
A. 平衡时,乙中CO2的转化率大于50%
B. 当反应平衡时,丙中c(CO2)是甲中的2倍
C. 温度升至800℃,上述反应平衡常数为25/16,则正反应为吸热反应
D. 其他条件不变,若起始时向容器乙中充入0.10mol/L H2和0.20 mol/L CO2,到达平衡时c (CO)与乙不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两烧杯中分别盛有100mL 3mol/L的硫酸和NaOH溶液,向两烧杯中各加入等质量的铝粉,反应结束后测得生成的气体体积比为甲︰乙=2︰3,则加入铝粉的质量为
A.5.4gB.7.2gC.8.1gD.10.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一烃A,能发生如图所示的一系列转化:
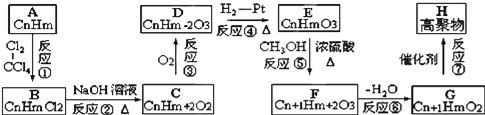
已知两个E分子间可发生缩合反应生成环状化合物C6H8O4,试解答下列问题:
(1)写出A和E的结构简式__、__。
(2)在反应①﹣⑦属于取代反应的有__。
(3)写出下列反应的化学方程式:
反应①__。
反应④__。
反应⑦__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是五种主族元素的结构特点及其元素、单质、化合物的性质.
元素 | 结构特点及元素、单质、化合物的性质 |
X | 气态氢化物与最高价氧化物对应水化物可以化合成盐 |
Y | 原子中s电子数与p电子数相同,且p电子的能量最高 |
Z | 单质在空气中燃烧产生黄色火焰,生成黄色粉末 |
W | 最外层电子排布(n+1)sn(n+1)pn﹣1 |
T | 单质升华可以产生紫色的烟 |
(1)写出X元素的原子核外电子排布__;其单质的化学性质__(填“稳定”或“活泼”),该元素的非金属性__(填“强”或“弱”),证明其强弱的理由是__.
(2)Z单质在空气中燃烧生成黄色粉末,写出该物质的电子式__;已知w的氯化物在177.8°C时会发生升华现象,由此可以判断它的晶体类型为__.
(3)W的最高价氧化物对应水化物可以与X、Z的最高价氧化物对应水化物反应,写出反 应的离子方程式:__,__.
(4)一种元素有多种可变价态,一般高价氧化物对应水化物成酸,低价氧化物对应水化物成碱.Y、T可形成多种化合物,其中T元素的化合价为+3、+5时,形成的化合物的化学式为__.
A.T2Y4 B.T4Y9 C.T6Y10 D.T2Y3.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中大多数元素是金属元素,金属及其化合物在生活生产中有着重要应用,根据试题信息,完成下列计算:
(1)某常见二价金属12.6g与足量稀硫酸反应,生成氢气5.04L(S.T.P),该元素原子的摩尔质量为__g/mol.
(2)39.32g某金属混合物,由12.32g镁和0.25mol另一种比镁不活泼的金属元素A组成,该混合物与一定量盐酸反应,产生氢气4.928L(S.T.P),则参加反应的HCl为__mol,金属A的相对原子质量为__.
(3)由NaCl、NaHCO3、Na2CO310H2O组成的混合物157.8g,充分加热后,产生的气体(气体温度150℃)依次通过无水CaCl2和碱石灰,两种吸收剂分别增重59.4g和13.2g,则混合物中NaHCO3的质量分数为___,若等质量的该混合物与足量盐酸反应,产生二氧化碳(S.T.P)__L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化为吸热反应的是
A.H2O(l)=H2O(g);ΔH=+44.0 kJ/mol
B.在高温条件下碳与水蒸气的反应
C.形成化学键时共放出能量862 kJ的化学反应
D.能量变化如图所示的化学反应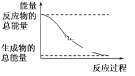
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物。进行如下实验:
①取适量A进行铝热反应,产物中有单质B生成;
②另取20gA全部溶于0.15L 6.0molL-1盐酸中,得溶液C;
③将①中得到的单质B和溶液C反应,放出1.12L(标况)气体。同时生成溶液D,还残留有固体物质B;
④用KSCN溶液检查时,溶液D不变色。
请填空:
(1)①中引发铝热反应的实验操作是_________________________________________,产物中的单质是___________。
(2)②中所发生的各反应的化学方程式是_______________________________________。
(3)③中所发生的各反应的离子方程式是 _________________________。
(4)若溶液D的体积仍视为0.15L,则该溶液中c(Mg2+)为 _______________。c(Fe2+)为_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com