
【题目】有一烃A,能发生如图所示的一系列转化:
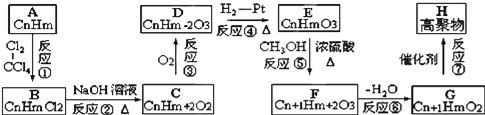
已知两个E分子间可发生缩合反应生成环状化合物C6H8O4,试解答下列问题:
(1)写出A和E的结构简式__、__。
(2)在反应①﹣⑦属于取代反应的有__。
(3)写出下列反应的化学方程式:
反应①__。
反应④__。
反应⑦__。
【答案】CH3CH=CH2 CH3CH(OH)COOH ②⑤ CH3CH=CH2+Cl2![]() CH3CHClCH2Cl
CH3CHClCH2Cl ![]() +H2
+H2![]() CH3CH(OH)COOH nCH2=CHCOOCH3
CH3CH(OH)COOH nCH2=CHCOOCH3![]()
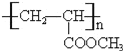
【解析】
A与氯气反应生成B,由A、B的分子式可知,为加成反应,故A烯烃,B发生水解反应生成C为醇,C发生氧化反应生成D,由H原子数目、及氧原子数目变化可知,应是﹣OH氧化为羰基、﹣COOH,D与氢气发生加成反应生成E,应是羰基被还原为﹣OH,E分子中含有1个﹣OH、1个﹣COOH,两个E分子间可发生缩合反应生成环状化合物C6H8O4,应是脱去2分子水发生酯化反应形成的环酯,故E的分子式为C3H6O3,结合D中含有羰基,故E为CH3CH(OH)COOH,逆推可得,D为![]() 、C为CH3CH(OH)CH2OH、B为CH3CHClCH2Cl、A为CH3CH=CH2.E与甲醇发生酯化反应生成F为CH3CH(OH)COOCH3,F发生消去反应生成G为CH2=CHCOOCH3,G发生加聚反应生成高聚物H为
、C为CH3CH(OH)CH2OH、B为CH3CHClCH2Cl、A为CH3CH=CH2.E与甲醇发生酯化反应生成F为CH3CH(OH)COOCH3,F发生消去反应生成G为CH2=CHCOOCH3,G发生加聚反应生成高聚物H为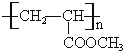 ,据此解答。
,据此解答。
(1)由上述分析可知,A为CH3CH=CH2,E为CH3CH(OH)COOH;
(2)反应①④属于加成反应,反应②⑤属于取代反应,反应③属于氧化反应,反应⑥属于消去反应,反应⑦属于加聚反应;
(3)反应①的方程式为:CH3CH=CH2+Cl2 ![]() CH3CHClCH2Cl;
CH3CHClCH2Cl;
反应④的方程式为:![]() +H2
+H2![]() CH3CH(OH)COOH;
CH3CH(OH)COOH;
反应⑦的方程式为:nCH2=CHCOOCH3![]()
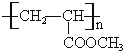 。
。


科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂,而且与Cl2相比不会产生对人体有潜在危害的有机氯代物。已知: ClO2浓度过高或受热易分解,甚至会爆炸。现有下列制备ClO2的方法:
(1)方法一:氧化法
可用亚氯酸钠和稀盐酸为原料制备,反应原理为5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O。
①该反应中氧化剂和还原剂的物质的量之比是_______________________。
②研究表明:若反应开始时盐酸浓度较大,则气体产物中有Cl2,用离子方程式解释产生Cl2的原因__________________________________________________。
(2)方法二:草酸还原法
在酸性溶液中用草酸(H2C2O4)还原氯酸钠的方法来制备ClO2
①写出制备ClO2的离子方程式:__________________________________________;
②与电解法相比,用草酸还原法制备ClO2的特点是____________________,提高了生产、储存及运输过程的安全性。
(3)已知: ClO2被I-还原为ClO2-、Cl-的转化率与溶液pH 的关系如图所示。当pH<2.0 时,ClO2-也能被I- 完全还原为Cl-。反应生成的I2与Na2S2O3 反应的方程式: 2Na2S2O3+ I2= Na2S4O6 + 2NaI。用ClO2消毒的饮用水中含有ClO2、ClO2-。测定饮用水中ClO2、ClO2-的含量,分两步进行:
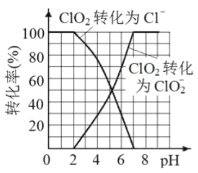
①用紫外分光光度法测得水样中ClO2的含量为a mol/L。
②用滴定法测量ClO2-的含量。请完成相应的实验步骤:
步骤1: 准确量取V mL 上述水样加入锥形瓶中。
步骤2: 调节水样的pH小于2。
步骤3: 加入足量的KI 晶体,充分反应。
步骤4: 加入少量淀粉溶液,用c mol/L Na2S2O3 溶液滴定至终点,消耗Na2S2O3 溶液V1 mL。
根据上述分析数据,测得该饮用水中ClO2-的浓度为___________mol/L( 用含字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向20mL0.1mol·L-1H3PO2溶液中滴加0.1mol·L-1的NaOH溶液,滴定曲线如图1,含磷微粒物质的量浓度所占分数(δ)随pH变化关系如图2。下列说法不正确是

A. H3PO2的电离方程式为H3PO2![]() H2PO2-+H+ Ka≈10-5
H2PO2-+H+ Ka≈10-5
B. B点时,溶液中存在关系:2c(H+)+c(H2PO2-)=2c(OH-)+c(H3PO2)
C. C点时,溶液中存在关系:c(Na+)+c(H+)=C(H2PO2-)+c(OH-)
D. D点时,溶液中微粒浓度大小关系:c(Na+)>c(H2PO2-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法中正确的是()
A.Ksp(AB2)<Ksp(CD),说明AB2的溶解度小于CD的溶解度
B.在ZnS的沉淀溶解平衡体系中加入蒸馏水,ZnS的Ksp增大
C.AgCl分别在同浓度的CaCl2溶液和NaCl溶液中溶解度不同
D.在CaCO3的沉淀溶解平衡体系中加入稀盐酸,沉淀溶解平衡不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按照要求回答下列问题
(1)硫酸铁溶液显酸性的原因_____(用离子方程式表示).
(2)物质的量浓度相同的醋酸和氢氧化钠溶液混合溶液中c(CH3COO﹣)=c(Na+),则混合后溶液显_____性.
(3)浓度均为0.1mol/L①氯化铵②醋酸铵③硫酸氢铵④氨水四种溶液中,c(NH4+)由大到小的顺序_____(填序号).
(4)将化合物A的蒸气1mol充入0.5L容器中加热分解:2A(g)B(g)+nC(g),反应到3min时,容器内A的浓度为0.8mol/L,测得这段时间内,平均速率ν(C)=0.6mol/(Lmin),则化学方程式中的n值为_____,ν(B)=_____,此时A的分解率为_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香化合物A(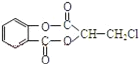 )在一定条件下可以发生如图所示的转化(其他产物和水已略去)。
)在一定条件下可以发生如图所示的转化(其他产物和水已略去)。
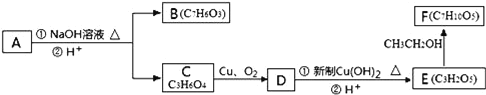
请回答下列问题:
(1)请写出A中包含的官能团的名称:__。
(2)有机物C可以由乳酸经过几步有机反应制得,其中最佳的次序是__。
A.消去、加成、水解、酸化 B.氧化、加成、水解、酸化
C.取代、水解、氧化、酸化 D.消去、加成、水解、氧化
(3)写出由E制得F的化学方程式:__。
(4)1molA在氢氧化钠溶液中加热,充分反应消耗氢氧化钠__mol,写出该反应的化学方程式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)第三周期元素的原子所形成的简单离子中:半径最大的阴离子是__;氧化性最强的阳离子是__.
(2)下列事实可以作为S和Cl非金属性强弱的判断依据的是__(选填序号)
a.Cl的最高正价比S高 b.可用浓H2SO4制HCl
c.HCl的酸性比H2S强 d.Cl2与H2S反应生成S.
(3)硅元素最外层有__种能量不同的电子;SiCl4的空间构型和CH4相同,写出SiCl4的电子式:__.
(4)PH3和NH3的某些化学性质相似.下列对晶体PH4I性质的推测,错误的是__(选填序号)
a.PH4I是一种共价化合物 b.PH4I能与烧碱溶液反应
c.PH4I加热后会发生升华 d.PH4I溶液能与溴水反应.
(5)二氯化二硫(S2C12)可用作橡胶工业的硫化剂,它的分子结构与H2O2相似.下列有关说法不正确的是__(选填序号)
a.S2C12分子中有4对共用电子对
b.S2C12分子中没有非极性键
c.S2C12分子中,S为+1价,Cl为﹣1价
d.S2C12分子中各原子均为8电子稳定结构.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中:①甲苯②聚异戊二烯③汽油④![]() ⑤聚乙烯⑥
⑤聚乙烯⑥![]() ,⑦丁子香酚
,⑦丁子香酚 ,根据题意,填写序号.
,根据题意,填写序号.
(1)既能使溴水褪色,也能使酸性高锰酸钾褪色的烃是__.
(2)能和碳酸氢钠反应的是__,写出它与碳酸氢钠反应的方程式__.
(3)写出⑥与足量氢氧化钠溶液共热反应的方程式__.
(4)丁子香酚不具有的性质是__(填序号);
A.易溶于水 B.通常状况下呈固态
C.可发生消去反应 D.遇FeCl3溶液显紫色.
(5)丁子香酚有多种同分异构体,写出符合下列要求的两个同分异构体的结构简式:__等.
①苯环上的一氯取代物为两种; ②遇FeCl3溶液显色; ③能发生银镜反应.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电气石是一种具有保健作用的天然石材,其中含有的主要元素为B、Si、Al、Mg、Na、O等元素。
(1)上述元素中,原子半径最小的是_________(用元素符号表示),在元素周期表中处于金属和非金属分界线附近的元素是_____________(用元素符号表示);
(2)表示原子结构的化学用语有:原子结构示意图、核外电子排布式、轨道表示式,从中选择最详尽描述核外电子运动状态的方式,来表示氧元素原子核外电子的运动状态______________;
(3)B与最活泼的非金属元素F形成化合物BF3,检测发现BF3分子中三根B—F键的键长相等,三根键的键角相等,能否仅仅依据此数据此判断BF3分子的极性____________;
(4)SiO2晶体的熔点比BF3晶体________(选填“高”、“低”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com