
【题目】700℃时,H2(g)+CO2(g)![]() H2O(g)+CO(g)。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2和CO2,起始浓度如下表所示。其中甲经2min达平衡时,v(H2O)为0.025 mol/(L·min),下列判断不正确的是()
H2O(g)+CO(g)。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2和CO2,起始浓度如下表所示。其中甲经2min达平衡时,v(H2O)为0.025 mol/(L·min),下列判断不正确的是()
起始浓度 | 甲 | 乙 | 丙 |
C(H2)/mol/L | 0.1 | 0.2 | 0.2 |
C(CO2)/mol/L | 0.1 | 0.1 | 0.2 |
A. 平衡时,乙中CO2的转化率大于50%
B. 当反应平衡时,丙中c(CO2)是甲中的2倍
C. 温度升至800℃,上述反应平衡常数为25/16,则正反应为吸热反应
D. 其他条件不变,若起始时向容器乙中充入0.10mol/L H2和0.20 mol/L CO2,到达平衡时c (CO)与乙不同
【答案】D
【解析】
试题A、根据水的反应速率,生成水蒸气的物质的量浓度为0.025×2mol·L-1=0.05mol·L-1,则消耗CO2的物质的量浓度为0.05mol·L-1,推出CO2的转化率为0.05/0.1×100%=50%,乙可以看作是在甲的基础上再通入H2,增加反应物的浓度,平衡向正反应方向移动,CO2的转化率增大,即大于50%,故说法正确;B、反应前后气体系数之和相等,因此甲和丙互为等效平衡,即丙中c(CO2)是甲中c(CO2)的2倍,故说法正确;C、700℃时,H2(g)+CO2(g)![]() H2O(g)+CO(g)
H2O(g)+CO(g)
起始: 0.1 0.1 0 0
变化: 0.05 0.05 0.05 0.05
平衡: 0.05 0.05 0.05 0.05
根据化学平衡常数的定义,K=0.05×0.05/(0.05×0.05)=1,温度升高至800℃,此时平衡常数是25/16>1,说明升高温度平衡向正反应方向移动,根据勒夏特列原理,正反应方向是吸热反应,故说法正确;D、若起始时,通入0.1mol·L-1H2和0.2mol·L-1CO2,转化率相等,因此达到平衡时c(CO)相等,故说法错误。


科目:高中化学 来源: 题型:
【题目】在25 ℃,,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/(mol·L-1) | 1 | 2 | 0 |
平衡浓度/(mol·L-1) | 0.6 | 1.2 | 0.8 |
下列说法错误的是( )
A. 反应达到平衡时,X的转化率为40%
B. 反应可表示为X(g)+2Y(g) ![]() 2Z(g),其平衡常数为0.74
2Z(g),其平衡常数为0.74
C. 其它条件不变时,增大压强能使平衡向生成Z的方向移动,平衡常数也增大
D. 改变温度可以改变此反应的平衡常数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属腐蚀与防护的说法不正确的是
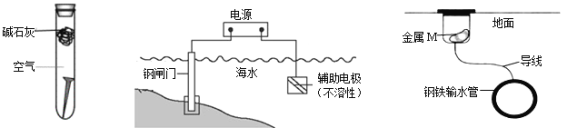
图① 图② 图③
A. 图①,放置于干燥空气中的铁钉不易生锈
B. 图②,若断开电源,钢闸门将发生吸氧腐蚀
C. 图②,若将钢闸门与电源的正极相连,可防止钢闸门腐蚀
D. 图③,若金属M比Fe活泼,可防止输水管腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的,如下图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化。则下列说法正确的是

A. 通常情况下,NO比N2稳定
B. 通常情况下,N2(g)和O2(g)混合能直接生成NO
C. 1molN2(g)和1molO2(g)具有的总能量小于2mol NO(g)具有的总能量
D. 1molN2(g)和1molO2(g)反应放出的能量为180kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人工光合作用能够借助太阳能,用CO2和H2O制备化学原料。下图是通过人工光合作用制备HCOOH的原理示意图,下列说法不正确的是
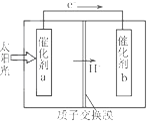
A. 该过程是将太阳能转化为化学能的过程
B. 催化剂a表面发生氧化反应,有O2产生
C. 催化剂a附近酸性减弱,催化剂b附近酸性增强
D. 催化剂b表面的反应是CO2+2H++2e一=HCOOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有K2Cr2O7的废水具有较强的毒性,工业上常用钡盐沉淀法处理含有K2Cr2O7的废水并回收重铬酸,具体的流程如下:
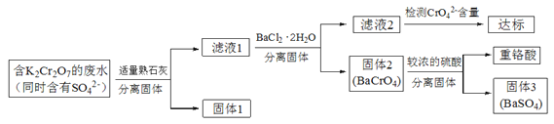
已知:i. CaCr2O7、BaCr2O7易溶于水,其它几种盐在常温下的溶度积如下表所示。
物质 | CaSO4 | CaCrO4 | BaCrO4 | BaSO4 |
溶度积 |
|
|
|
|
ii. Cr2O72-+ H2O![]() 2 CrO42-+ 2H+
2 CrO42-+ 2H+
(1)向滤液1中加入BaCl2·H2O的目的,是使CrO42-从溶液中沉淀出来。
①结合上述流程说明熟石灰的作用是_______________________________。
②结合表中数据,说明选用Ba2+而不选用Ca2+处理废水的理由是________________。
③研究温度对CrO42-沉淀效率的影响。实验结果如下:在相同的时间间隔内,不同温度下CrO42-的沉淀率![]() ,
,
如下图所示。
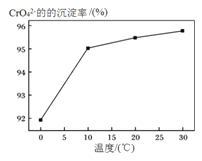
已知:BaCrO4(s) ![]() Ba2+ (aq) + CrO42-(aq)
Ba2+ (aq) + CrO42-(aq)
CrO42-的沉淀效率随温度变化的原因是___________________________________。
(2)向固体2中加入硫酸,回收重铬酸。
① 硫酸浓度对重铬酸的回收率如下图(左)所示。结合化学平衡移动原理,解释使用0.450 mol/L的硫酸时,重铬酸的回收率明显高于使用0.225 mol/L的硫酸的原因是_________________________________。
② 回收重铬酸的原理如下图(右)所示。当硫酸浓度高于0.450 mol/L时,重铬酸的回收率没有明显变化,其原因是_______________________________。
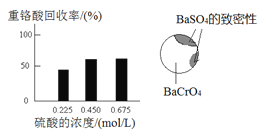
(3)综上所述,沉淀BaCrO4并进一步回收重铬酸的效果与___________有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探索工业含铝、铁、铜合金废料的再利用,甲同学设计的实验方案如下:

请回答:
(1)胆矾的化学式为___________。
(2)写出反应①的化学方程式____________________,反应②生成沉淀的离子方程式____________________。
(3)为了检测滤液D中含有的金属离子,可设计实验方案为(试剂自选):__________________________________。
(4)在滤渣B中滴加稀硫酸时,发现反应速率比一般的铁粉反应要快,其原因是_______________________________________________。
(5)若考虑绿色化学工艺,在滤渣E中加入稀硫酸和试剂Y制胆矾晶体,试剂Y为具有强氧化性的无色液体,则反应④的总化学方程式为___________;若不考虑绿色化学工艺, 试剂Y可选1 mol·L-1的硝酸,欲使3 mol Cu全部溶解且溶液中含铜元素的溶质仅为CuSO4,则需该硝酸的体积为_______L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com