
【题目】为探索工业含铝、铁、铜合金废料的再利用,甲同学设计的实验方案如下:

请回答:
(1)胆矾的化学式为___________。
(2)写出反应①的化学方程式____________________,反应②生成沉淀的离子方程式____________________。
(3)为了检测滤液D中含有的金属离子,可设计实验方案为(试剂自选):__________________________________。
(4)在滤渣B中滴加稀硫酸时,发现反应速率比一般的铁粉反应要快,其原因是_______________________________________________。
(5)若考虑绿色化学工艺,在滤渣E中加入稀硫酸和试剂Y制胆矾晶体,试剂Y为具有强氧化性的无色液体,则反应④的总化学方程式为___________;若不考虑绿色化学工艺, 试剂Y可选1 mol·L-1的硝酸,欲使3 mol Cu全部溶解且溶液中含铜元素的溶质仅为CuSO4,则需该硝酸的体积为_______L。
【答案】CuSO4·5H2O 2Al+2NaOH+2H2O![]() 2NaAlO2+3H2↑ AlO2-+CO2+2H2O
2NaAlO2+3H2↑ AlO2-+CO2+2H2O![]() Al(OH)3↓+HCO3- 用试管取少量滤液D,向滤液中滴加KSCN(或NaSCN、或NH4SCN)溶液无明显现象,再滴入氯水(或H2O2溶液,或通入Cl2),若变成红色,则溶液中存在Fe2+或者用试管取少量滤液D,向滤液中滴加几滴K3[Fe(CN)6],若有蓝色沉淀生成,则溶液中存在Fe2+ 铜、铁与稀硫酸形成了原电池 Cu+H2O2+H2SO4
Al(OH)3↓+HCO3- 用试管取少量滤液D,向滤液中滴加KSCN(或NaSCN、或NH4SCN)溶液无明显现象,再滴入氯水(或H2O2溶液,或通入Cl2),若变成红色,则溶液中存在Fe2+或者用试管取少量滤液D,向滤液中滴加几滴K3[Fe(CN)6],若有蓝色沉淀生成,则溶液中存在Fe2+ 铜、铁与稀硫酸形成了原电池 Cu+H2O2+H2SO4![]() CuSO4+2H2O 2
CuSO4+2H2O 2
【解析】
合金加入足量的烧碱溶液后,金属铝溶解,滤渣为铁、铜;滤液A中通入二氧化碳气体,得到氢氧化铝沉淀;滤渣B加入稀硫酸,铁与稀硫酸反应,且会形成铁铜原电池。
(1)胆矾为五水合硫酸铜,化学式为CuSO45H2O,故答案为:CuSO45H2O;
(2)金属铝可以和强碱氢氧化钠发生反应生成偏铝酸钠和氢气,即2Al+2NaOH+2H2O=
2NaAlO2+3H2↑,偏铝酸钠溶液中通入过量二氧化碳,生成氢氧化铝沉淀,即AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-;
(3)亚铁离子可以和强碱反应生成氢氧化亚铁沉淀,迅速被氧化为氢氧化铁,故亚铁离子的检验方法:用试管取少量滤液D,向滤液中滴加铁氰化钾,有蓝色沉淀产生,液则中存在Fe2+,或向滤液中滴加KSCN(或NaSCN、或NH4SCN)]溶液无明显现象,再滴入氯水(或双氧水,或通入Cl2)若变成血红色,则溶液中存在Fe2+,故答案为:用试管取少量滤液D,向滤液中滴加铁氰化钾,有蓝色沉淀产生,液则中存在Fe2+,或向滤液中滴加KSCN(或NaSCN、或NH4SCN)]溶液无明显现象,再滴入氯水(或双氧水,或通入Cl2)若变成红色,则溶液则中存在Fe2+;
(4)在滤渣B中滴加稀硫酸时,溶液中铜、铁与稀硫酸形成了许多微小的原电池,构成了电化学腐蚀,加快了反应速率,故答案为:铜、铁与稀硫酸形成了原电池;
(5)双氧水是一种绿色氧化剂,在双氧水的作用下,金属铜可以和硫酸发生反应:Cu+H2O2+H2SO4=CuSO4+2H2O,铜和硝酸、硫酸反应化学方程式:3Cu+2HNO3+3H2SO4=3CuSO4++2NO↑+4H2O,3mol Cu全部溶解消耗硝酸2mol,则该硝酸的体积=2mol÷1mol/L=2L,故答案为:Cu+H2O2+H2SO4=CuSO4+2H2O;2.


科目:高中化学 来源: 题型:
【题目】酚酞是常用的指示剂,其结构简式为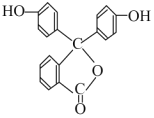 。
。
(1)酚酞的分子式为_____________。
(2)从其结构上看,酚酞属于_____或____类衍生物。
(3)酚酞分别在1mol/LHCl和1mol/LNaOH溶液中溶解,在__________中溶解度较大,其原因是______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】700℃时,H2(g)+CO2(g)![]() H2O(g)+CO(g)。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2和CO2,起始浓度如下表所示。其中甲经2min达平衡时,v(H2O)为0.025 mol/(L·min),下列判断不正确的是()
H2O(g)+CO(g)。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2和CO2,起始浓度如下表所示。其中甲经2min达平衡时,v(H2O)为0.025 mol/(L·min),下列判断不正确的是()
起始浓度 | 甲 | 乙 | 丙 |
C(H2)/mol/L | 0.1 | 0.2 | 0.2 |
C(CO2)/mol/L | 0.1 | 0.1 | 0.2 |
A. 平衡时,乙中CO2的转化率大于50%
B. 当反应平衡时,丙中c(CO2)是甲中的2倍
C. 温度升至800℃,上述反应平衡常数为25/16,则正反应为吸热反应
D. 其他条件不变,若起始时向容器乙中充入0.10mol/L H2和0.20 mol/L CO2,到达平衡时c (CO)与乙不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)氯碱工业中电解饱和食盐水流程及原理示意图如下图所示。
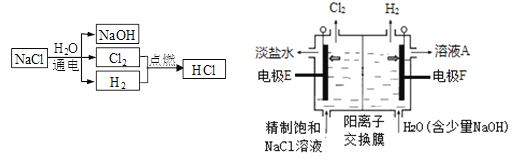
(1)生成H2的电极反应式是_________________________________________。
(2)Na+向________(填“E”或“F”)方向移动,溶液A的溶质是______________。
(3)电解饱和食盐水总反应的离子方程式是_____________________________。
(4)常温下,将氯碱工业的附属产品盐酸与氨水等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表。
实验编号 | 氨水浓度/mol·L-1 | 盐酸浓度/mol·L-1 | 混合溶液pH |
① | 0.1 | 0.1 | pH=5 |
② | c | 0.2 | pH=7 |
③ | 0.2 | 0.1 | pH>7 |
ⅰ. 实验①中所得混合溶液,由水电离出的c(H+)=______ mol·L-1。
ⅱ. 实验②中,c______0.2(填“>”“<”或“=”)。
ⅲ. 实验③中所得混合溶液,各离子浓度由大到小的顺序是__________________。
ⅳ. 实验①、③所用氨水中的![]() :①___________③(填“>”“<”或“=”)。
:①___________③(填“>”“<”或“=”)。
(5)氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强。25℃时氯气-氯水体系中的Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如下图所示。

下列表述正确的是_______。
A. 氯处理饮用水时,在夏季的杀菌效果比在冬季好
B. 在氯处理水体系中,c(HClO)+c(ClO-)=c(H+)-c(OH-)
C. 用氯处理饮用水时,pH=7.5时杀菌效果比pH=6.5时效果差
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在溶液中能大量共存的是( )
A.H+、Na+、HCO3-、NO3-B.Ag+、NO3-、Cl-、Na+
C.Na+、Mg2+、SO42-、Cl-D.Na+、H+、OH-、ClO—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲苯(![]() )是一种重要的化工原料,能用于生产苯甲醛(
)是一种重要的化工原料,能用于生产苯甲醛(![]() )、苯甲酸(
)、苯甲酸(![]() )等产品。下表列出了有关物质的部分物理性质,请回答:
)等产品。下表列出了有关物质的部分物理性质,请回答:
名称 | 性状 | 熔点(℃) | 沸点(℃) | 相对密度 (ρ水=1g/cm3) | 溶解性 | |
水 | 乙醇 | |||||
甲苯 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8660 | 不溶 | 互溶 |
苯甲醛 | 无色液体 | -26 | 179 | 1.0440 | 微溶 | 互溶 |
苯甲酸 | 白色片状或针状晶体 | 122.1 | 249 | 1.2659 | 微溶 | 易溶 |
注:甲苯、苯甲醛、苯甲酸三者互溶。
实验室可用如图装置模拟制备苯甲醛。实验时先在三颈瓶中加入0.5g固态难溶性催化剂,再加入15mL冰醋酸(作为溶剂)和2mL甲苯,搅拌升温至70℃,同时缓慢加入12mL过氧化氢,在此温度下搅拌反应3小时。

(1)装置a的名称是__________________,主要作用是____________________。
(2)三颈瓶中发生反应的化学方程式为_______________________________________,此反应的原子利用率理论上可达___________。(原子利用率=(期望产物的总质量/全部反应物的总质量)×100%)
(3)经测定,反应温度升高时,甲苯的转化率逐渐增大,但温度过高时,苯甲醛的产量却有所减少,可能的原因是________________________________________________。
(4)反应完毕后,反应混合液经过自然冷却至室温时,还应经过 ________、________(填操作名称)等操作,才能得到苯甲醛粗产品。
(5)实验中加入过量过氧化氢且反应时间较长,会使苯甲醛产品中产生较多的苯甲酸。若想从混有苯甲酸的苯甲醛中分离出苯甲酸,正确的操作步骤是_______(按步骤顺序填字母)。
a.对混合液进行分液 b.过滤、洗涤、干燥
c.层中加入盐酸调节pH=2 d.加入适量碳酸氢钠溶液混合震荡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其化合物有许多用途,相关物质的物理常数如下表所示:

回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为____________________________,基态S原子电子占据最高能级的电子云轮廓图为________形。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是__。
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为__________________。

(4)气态三氧化硫以单分子形式存在,其分子的立体构型为________形,其中共价键的类型有________种;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为________。
(5)FeS2晶体的晶胞如图(c)所示。晶胞边长为anm、FeS2相对式量为M、阿伏加德罗常数的值为NA,其晶体密度的计算表达式为______________________________g·cm-3;晶胞中Fe2+位于![]() 所形成的正八面体的体心,该正八面体的边长为________nm。
所形成的正八面体的体心,该正八面体的边长为________nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() I是常规核裂变产物之一,可以通过测定大气或水中
I是常规核裂变产物之一,可以通过测定大气或水中![]() I的含量变化来检测核电 站是否发生放射性物质泄漏。下列有关
I的含量变化来检测核电 站是否发生放射性物质泄漏。下列有关![]() I的叙述中错误的是( )
I的叙述中错误的是( )
A. ![]() I的化学性质与
I的化学性质与![]() I相同B.
I相同B. ![]() I的原子核外电子数为78
I的原子核外电子数为78
C. ![]() I的原子序数为53D.
I的原子序数为53D. ![]() I的原子核内中子数多于质子数
I的原子核内中子数多于质子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若下列图像中横轴代表所加溶液体积,纵坐标代表生成沉淀质量,则各项描述中与图像能对应的是( )

A. 图①可能是MgCl2、AlCl3溶液逐滴加氨水至过量
B. 图②可能是AlCl3溶液逐滴加NaOH溶液至过量
C. 图③可能是NaAlO2溶液滴加稀盐酸至过量
D. 图④可能是含一定量HCl的AlCl3溶液逐滴加氨水至过量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com