
【题目】某温度下,在一容积固定的容器中,反应xA(g)+yB(g)![]() zH(g)达到平衡后,A、B、H的物质的量分别为amol、bmol和hmol。已知x+y=2z,若保持温度不变,将三者的物质的量增大一倍,则下列判断正确的是( )
zH(g)达到平衡后,A、B、H的物质的量分别为amol、bmol和hmol。已知x+y=2z,若保持温度不变,将三者的物质的量增大一倍,则下列判断正确的是( )
A.平衡不移动B.混合气体的密度不变
C.B的体积分数减少D.amol/L<c(A)<2amol/L
【答案】C
【解析】
A. 已知x+y=2z,证明反应是气体体积减小的反应,若保持温度不变,将三者的物质的量增大一倍,压强增大,平衡正向进行,故A错误;
B. 混合气体密度等于混合气体质量除以体积,若保持温度不变,将三者的物质的量增大一倍,体积不变,质量增大,混合气体密度增大,故B错误;
C. 若保持温度不变,将三者的物质的量增大一倍,平衡正向移动,B的体积分数减小,故C正确;
D. 若保持温度不变,将三者的物质的量增大一倍,不考虑平衡移动,A的物质的量为原来的2倍,但压强增大平衡正向进行所以A的物质的量小于原来的2倍,即A的物质的量应为amol<n(A)<2amol,不知道体积,无法确定浓度大小,故D错误;
故选C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】室温下,用0.100mol·L-1的NaOH溶液分别滴定均为20.00mL0.100mol·L-1的HCl溶液和醋酸溶液,滴定曲线如图所示。下列说法正确的是

A. I表示的是滴定醋酸的曲线
B. pH =7时,滴定醋酸消耗的V(NaOH)>20.00mL
C. V(NaOH)= 20.00mL时,两份溶液中c(Cl-)>c(CH3COO-)
D. V(NaOH)=10.00mL时,醋酸中c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.1000 mol·L-1NaOH溶液滴定20.00 mL未知浓度的盐酸(酚酞作指示剂)的滴定曲线如图所示。下列说法正确的是( )

A.溶液中的氢离子浓度:a<b
B.盐酸的物质的量浓度为0.0100mol·L-1
C.指示剂变色时,说明盐酸与NaOH恰好完全反应
D.当滴加NaOH溶液10.00mL时(忽略反应前后体积变化),该混合液的pH=1+lg3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,有浓度均为1 mol·L-1的下列4种溶液:
①H2SO4溶液 ②NaHCO3溶液 ③NH4Cl溶液 ④NaOH溶液
(1)这4种溶液pH由大到小的排列顺序是______________(填序号),其中由水电离出的H+浓度最小的是______________(填序号)。
(2)该温度下②中NaHCO3的水解平衡常数Kh=______________mol·L-1。(已知碳酸的电离常数K1=4×10-7,K2=5.6×10-11)
(3)该温度下向③中通入少量氨气,此时c(NH4+): c(NH3·H2O)的值________(填“增大”、“减小”或“不变”)。
(4)若将③和④混合后溶液恰好呈中性,则混合前③的体积___④的体积(填“大于”、“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】TiO2广泛应用于涂料、塑料、造纸、印刷油墨等领域。TiOSO4溶液加水稀释可析出aTiO2·bH2O沉淀。
(1)写出TiOSO4溶液加水稀释时所发生反应的化学方程式:____。
(2)实验室测定aTiO2·bH2O组成的方法如下:
步骤一:取样品4.900 g,在酸性条件下充分溶解,加入适量铝将溶解生成的TiO2+还原为Ti3+,将溶液转移到容量瓶中,并定容至250 mL。
步骤二:取25.00 mL定容后的溶液于锥形瓶中,加入KSCN溶液作指示剂,用0.2000mol·L-1的NH4Fe(SO4)2 标准溶液滴定,将实验数据记录在下表中。重复滴定2次。滴定过程发生的物质转化为:Ti3+![]() TiO2+
TiO2+
滴定序号 | 待测液体积/mL | NH4Fe(SO4)2标准溶液 | |
滴定管起点读数/mL | 滴定管终点读数/mL | ||
1 | 25.00 | 0.04 | 25.04 |
2 | 25.00 | 0.07 | 25.05 |
3 | 25.00 | 0.13 | 25.15 |
①使用滴定管过程中所涉及下列操作的先后顺序是____(填字母)。
a.排除滴定管尖嘴处的气泡 b.检查滴定管是否漏液 c.用待装液润洗滴定管
②滴定终点的实验现象是____。
③通过计算确定该样品的组成,写出计算过程____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C和H2在生产、生活、科技中是重要的燃料。
①2C(s)+O2(g) ===2CO(g) ΔH1=—220 kJ/mol
②
下列推断正确的是
A. C(s)的燃烧热110kJ/mol
B. 2H2(g)+O2(g)===2H2O(g)ΔH1=+480kJ/mol
C. C(s)+H2O(g)===CO(g)+H2(g)ΔH1=+130kJ/mol
D. 欲分解2molH2O(l),至少需要提供4×462kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下存在反应:2SO2(g) + O2(g) ![]() 2SO3(g),Δ H<0。现有三个体积相同的密闭容器Ⅰ、Ⅱ、Ⅲ,按如如图所示投料,并在400℃条件下开始反应。达到平衡时,下列说法正确的是
2SO3(g),Δ H<0。现有三个体积相同的密闭容器Ⅰ、Ⅱ、Ⅲ,按如如图所示投料,并在400℃条件下开始反应。达到平衡时,下列说法正确的是

A. 容器I、III中平衡常数相同
B. 容器II、III中正反应速率相同
C. 容器II、III中的反应达平衡时,SO3的体积分数:II>III
D. 容器I中SO2的转化率与容器II中SO3的转化率之和小于1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】课题式研究性学习是培养学生创造思维的良好方法。某研究性学习小组将下列装置如图连接,D、E、X、Y都是铂电极、C、F是铁电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答下列问题:

(1)B极的名称是___。
(2)甲装置中电解反应的总化学方程式是:___。
(3)设电解质溶液过量,电解后乙池中加入___(填物质名称)可以使溶液复原。
(4)设甲池中溶液的体积在电解前后都是500ml,乙池中溶液的体积在电解前后都是200mL,当乙池所产生气体的体积为4.48L(标准状况)时,甲池中所生成物质的物质的量浓度为___mol/L;乙池中溶液的pH=___;
(5)装置丁中的现象是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
Ⅰ.室温下,现有c(H+) 相同的醋酸甲和盐酸乙:
(1)相同条件下,取等体积的甲乙两溶液,各稀释100倍。稀释后的溶液,其c(H+) 大小关系为:
甲 _____________乙 (填“大于”“小于”或“等于”,下同)。
(2)各取25 mL的甲乙两溶液,分别与等浓度的NaOH稀溶液完全反应,则消耗的NaOH溶液的体积大小关系为V(甲) _____________ V(乙)。
Ⅱ.已知25 ℃时有关弱酸的电离平衡常数如下:
弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
(1)25 ℃时,将20 mL 0.1 mol·L-1 CH3COOH溶液和20 mL 0.1 mol·L-1 HSCN溶液分别与20 mL 0.1 mol·L-1 NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示:
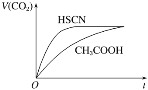
反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是 _____________。
(2)若保持温度不变,在醋酸溶液中通入一定量氨气,下列各量会变小的是 ______________(填字母)。
a.c(CH3COO-) b.c(H+) c.Kw d.醋酸电离平衡常数
III.(1)HClO4H2SO4HCl和HNO3都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数,下列说法不正确的是 _________。
酸 | HClO4 | H2SO4 | HCl | HNO3 |
Ka | 1.6×10-5 | Ka1:6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
A.温度会影响这四种酸在冰醋中的电离常数
B.在冰醋酸中HClO4是这四种酸中最强的酸
C.在冰醋酸中H2SO4的电离方程式为H2SO4===2H++SO42-
D.这四种酸在冰醋酸中都没有完全电离,但仍属于强电解质
(2)亚磷酸是二元中强酸,25 ℃时亚磷酸(H3PO3)的电离常数为K1=1×10-2K2=2.6×10-7。
①试从电离平衡移动的角度解释K1为什么比K2大_______________________ 。
②写出亚磷酸的电离方程式(2步)_________________;_______________ 。
③请设计一种方案,使之能通过直观的实验现象判断醋酸的酸性强于H2S,该方案所用的试剂是 __________,反应的化学方程式为 _____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com