
【题目】将CO2慢慢通入一定体积的NaOH溶液中,溶液的pH随CO2体积(标准状况下)的变化曲线如图所示,则下列说法中正确的是
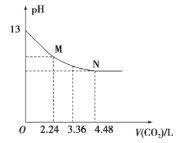
A. NaOH溶液的物质的量浓度为0.1 mol/L,体积为1 L
B. M、N点离子浓度的都是c(HCO3-)>c(CO32 -)
C. 曲线上任意点都符合:c(Na+)+c(H+)=c(CO32 -)+c(HCO3-)+c(OH-)
D. V=3.36 L时,溶液中的离子浓度关系是:c(Na+)>c(HCO3- )>c(CO32 -)>c(OH-)>c(H+)
【答案】D
【解析】
标准状况下4.48L二氧化碳的物质的量为0.2mol,2.24L二氧化碳的物质的量为0.1mol。据图可知,当通入0.2mol二氧化碳时,氢氧化钠与二氧化碳恰好反应生成NaHCO3,根据碳原子守恒,生成碳酸氢钠的物质的量为0.2mol,说明NaOH的物质的量也为0.2mol。
A.据图可知,没有通入二氧化碳之前,溶液的pH=13,则溶液中氢氧化钠的浓度为0.1mol/L,因为氢氧化钠的物质的量为0.2mol,则氢氧化钠溶液的体积为2L,故A错误;
B.M点时溶质为碳酸钠,溶液中离子浓度关系为:c(HCO3-)<c(CO32-),N点时溶质为碳酸氢钠,溶液中c(HCO3-)>c(CO32-),故B错误;
C.碳酸根离子带有2个单位的负电荷,碳酸根离子的系数应该为2,则溶液中的电荷守恒为:![]() ,故C错误;
,故C错误;
D.V=3.36L时,恰好生成0.05mol碳酸钠、0.1mol碳酸氢钠,CO32-的水解程度大于HCO3-的水解程度,则c(HCO3-)>c(CO32-),水解使溶液显碱性,则c(OH-)>c(H+),所以溶液中各离子浓度为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),故D正确,答案选D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】在同温同压下,在两个容积相同的容器中,一个盛有CO气体,另一个盛有CO2气体,则两容器内的气体一定具有相同的
A.密度 B.原子数 C.质量 D.分子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖。现向一密闭容器中充入1mol N2和3mol H2,在一定条件下使该反应发生:N2+3H2![]() 2NH3。下列有关说法正确的是( )
2NH3。下列有关说法正确的是( )
A. 达到化学平衡时,正反应和逆反应的速率都为零
B. 当符合:3正N2=正H2时,反应达到平衡状态
C. 达到化学平衡时,单位时间消耗a molN2,同时生成3a molH2
D. 当N2、H2、NH3的分子数比为1∶3∶2,反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)已知室温下CO的燃烧热为283 kJ/mo1,则CO的燃烧热的热化学方程式为___________________________________。
(2)工业上利用CO和H2合成清洁能源CH3OH,其反应为:CO(g)+2H2(g)![]() CH3OH(g) ΔH=-116kJ/mo1
CH3OH(g) ΔH=-116kJ/mo1
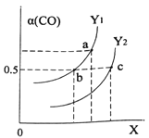
如图表示CO的平衡转化率(α)随温度和压强变化的示意图。X表示的是_____________,Y1_____Y2(填“<”、“=”、“>”)。
(3)合成甲醇的反应原理为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),在1L的密闭容器中,充入1mol CO2和3mol H2,在500℃下发生反应,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g),在1L的密闭容器中,充入1mol CO2和3mol H2,在500℃下发生反应,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。

①反应进行到4min时,v(正)____v(逆)(填“>”“<”或“=”)。0~4min,CO2的平均反应速率v(CO2)=____________mol·L1·min1。
②该温度下平衡常数为_____________。
③下列能说明该反应已达到平衡状态的是______________。
A.v正(CH3OH)=3v逆(H2)
B.CO2、H2、CH3OH和H2O浓度之比为1∶3∶1∶1
C.恒温恒压下,气体的体积不再变化
D.恒温恒容下,气体的密度不再变化
(4)为提高燃料的能量利用率,常将其设计为燃料电池。某电池以甲烷为燃料,空气为氧化剂,KOH溶液为电解质溶液,以具有催化作用和导电性能的稀土金属为电极。写出该燃料电池的负极反应式:_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于有机物![]()
![]() 的说法正确的是
的说法正确的是
A. a、b互为同系物
B. c中所有碳原子可能处于同一平面
C. a、b、c均能使酸性高锰酸钾溶液褪色
D. b的同分异构体中含有羧基的结构还有7种(不含立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气净化中的一个反应如下:2NO(g)+2CO(g)===N2(g)+2CO2(g),请回答下列问题:
(1)已知:N2(g)+O2(g)===2NO(g) ΔH=+180.5kJ·mol1
C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol1
2C(s)+O2(g)===2CO(g) ΔH=-221 kJ·mol1
则2NO(g)+2CO(g)===N2(g)+2CO2(g)的ΔH=____________kJ·mol1。
(2)一定温度下,向容积为1L的密闭容器中充入一定量的NO和CO。在t1时刻达到平衡状态,此时n(CO)=0.1mol,n(NO)=0.2mol,n(N2)=a mol,且平衡时混合气体压强为初始气体压强的0.8。
①则该反应的平衡常数K=____________。若保持温度及容器容积不变,平衡后在此基础上再向容器中充入2a mol的N2、0.2mol的NO,平衡将____________(填“向左”“向右”或“不”)移动。
②下列各种情况,可说明该反应已经达到平衡状态的是____________(填字母)。
A.v(CO2)生成=v(CO)消耗
B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变
D.NO、CO、N2、CO2的浓度均不再变化
E.单位时间内生成2n mol碳氧双键的同时消耗n mol N≡N
③在t2时刻,改变某一外界条件,正反应速率的变化曲线如图所示:可能改变的条件是____________、_________。

(3)有人提出可以用如图所示的电解原理的方法消除汽车尾气,写出阳极发生的电极反应式:________________________________________。
(4)如果要净化汽车尾气同时提高该反应的速率和NO的转化率,采用的措施是__________。
A.降低温度
B.增大压强同时加催化剂
C.升高温度同时充入N2
D.及时将CO2和N2从反应体系中移走
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某芳香烃A可以从煤干馏得到的煤焦油中分离出来,以A为原料可以合成聚邻氨基苯甲酸、扁桃酸等物质,其合成流程如下(部分产物、合成路线、反应条件已略去):
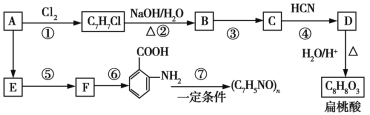
已知:
Ⅰ.R—CHO+HCN![]()
![]()
Ⅱ.R—CN![]() R—COOH
R—COOH
Ⅲ.![]()
![]()
![]() (苯胺易被氧化)
(苯胺易被氧化)
请回答下列问题:
(1)C的分子式为__________。
(2)下列对相关反应类型的判断合理的是__________ (填序号)。
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | |
Ⅰ | 加成 | 水解 | 还原 | 取代 | 还原 | 氧化 | 加聚 |
Ⅱ | 加成 | 消去 | 还原 | 加成 | 氧化 | 还原 | 缩聚 |
Ⅲ | 取代 | 水解 | 加成 | 氧化 | 还原 | 缩聚 | |
Ⅳ | 取代 | 消去 | 氧化 | 取代 | 还原 | 氧化 | 加聚 |
(3)写出反应③的化学方程式:______________________________。
(4)扁桃酸有多种同分异构体,其中既能与氯化铁溶液发生显色反应,又能与碳酸氢钠溶液反应产生气泡的同分异构体有__________种,写出其中一种的结构简式:__________________。
(5)以芳香烃A为主要原料,还可以通过下列合成路线合成阿司匹林和冬青油:

①冬青油的结构简式为____________________。
②写出反应Ⅴ的化学方程式:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4·xH2O)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务。
该组同学的研究课题是:探究测定草酸晶体(H2C2O4·xH2O)中的x值。通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:
2MnO![]() +5H2C2O4+6H+===2Mn2++10CO2↑+8H2O
+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O
学习小组的同学设计了如下步骤用滴定的方法测定x值。
①称取1.260 g纯草酸晶体,将其制成100.00 mL水溶液为待测液。
②取25.00 mL待测液放入锥形瓶中,再加入适量的稀H2SO4。
③用浓度为0.1000 mol·L-1的酸性KMnO4标准溶液进行滴定,达到终点时消耗10.00 mL。
(1)上述步骤②中使用的锥形瓶是否需要事先用待测液润洗_______。(填“是”或“否”)滴定时,将酸性KMnO4标准液装在如图中的________(填“甲”或“乙”)滴定管中。

(2)本实验滴定达到终点的标志可以是________________________________。
(3)通过上述数据,求得x=________。
讨论:①若滴定终点时俯视滴定管刻度,则由此测得的x值会________(填“偏大”、“偏小”或“不变”,下同)。
②根据上述实验计算的数据可信性不强,为了提高实验的准确性,请写出改进方法______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示的装置,C、D、E、F、X、Y都是惰性电极。A、B为电源,将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色。则以下说法正确的是

A. 电源B极是正极
B. 欲用丙装置给铜镀银,H应该是Cu,电镀液是AgNO3溶液
C. 甲、乙装置的C、E电极均有单质生成,其物质的量之比为1:1
D. 装置丁电解一段时间后溶液的pH不变。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com