
【题目】汽车尾气净化中的一个反应如下:2NO(g)+2CO(g)===N2(g)+2CO2(g),请回答下列问题:
(1)已知:N2(g)+O2(g)===2NO(g) ΔH=+180.5kJ·mol1
C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol1
2C(s)+O2(g)===2CO(g) ΔH=-221 kJ·mol1
则2NO(g)+2CO(g)===N2(g)+2CO2(g)的ΔH=____________kJ·mol1。
(2)一定温度下,向容积为1L的密闭容器中充入一定量的NO和CO。在t1时刻达到平衡状态,此时n(CO)=0.1mol,n(NO)=0.2mol,n(N2)=a mol,且平衡时混合气体压强为初始气体压强的0.8。
①则该反应的平衡常数K=____________。若保持温度及容器容积不变,平衡后在此基础上再向容器中充入2a mol的N2、0.2mol的NO,平衡将____________(填“向左”“向右”或“不”)移动。
②下列各种情况,可说明该反应已经达到平衡状态的是____________(填字母)。
A.v(CO2)生成=v(CO)消耗
B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变
D.NO、CO、N2、CO2的浓度均不再变化
E.单位时间内生成2n mol碳氧双键的同时消耗n mol N≡N
③在t2时刻,改变某一外界条件,正反应速率的变化曲线如图所示:可能改变的条件是____________、_________。

(3)有人提出可以用如图所示的电解原理的方法消除汽车尾气,写出阳极发生的电极反应式:________________________________________。
(4)如果要净化汽车尾气同时提高该反应的速率和NO的转化率,采用的措施是__________。
A.降低温度
B.增大压强同时加催化剂
C.升高温度同时充入N2
D.及时将CO2和N2从反应体系中移走
【答案】-746.5 270 向右 CD 增大反应物浓度 增大压强 CO-2e+4OH===CO32-+2H2O B
【解析】
(1)利用盖斯定律求反应热;
(2)利用三等式求平衡常数、利用浓度商和平衡常数的关系判断平衡移动方向;
(1) 所求反应2NO(g)+2CO(g)===N2(g)+2CO2(g),用盖斯定律知其等于②×2-①-③,ΔH=ΔH2-ΔH1-ΔH3,可得ΔH=-746.5 kJ·mol1,答案ΔH=-746.5 kJ·mol1。
(2)列出“三段式”:
2NO(g)+2CO(g) ===N2(g)+2CO2(g)
起始(mol):2a+0.2 2a+0.1 0 0
转化(mol): 2a 2a a 2a
平衡(mol): 0.2 0.1 a 2a
依题意得:0.2+0.1+a+2a=0.8(2a+0.2+2a+0.1),解得:a=0.3
平衡时 0.2 0.2 0.3 0.6
①该反应的平衡常数![]() 。平衡后在此基础上再向容器中充入2a mol的N2、0.2 mol的NO时,各物质的浓度变成了0.4、0.2、0.9、0.6。
。平衡后在此基础上再向容器中充入2a mol的N2、0.2 mol的NO时,各物质的浓度变成了0.4、0.2、0.9、0.6。![]() ,Q<K,正向移动。答案为270 向右;
,Q<K,正向移动。答案为270 向右;
②A项,v(CO2)消耗是向正反应方向,v(CO)生成也是向正反应方向,不能说明达到平衡状态;B项,由ρ(混合气体)=m(混合气体)/V知,密闭容器中m(混合气体)和V都不变,比值不变,即ρ(混合气体)不变,故密度不再改变不能说明达到平衡状态;C项,由M(混合气体)=m(混合气体)/n(混合气体)知,密闭容器中m(混合气体)不变,n(混合气体)向正反应方向移动时减小,向逆反应方向移动时增大,故平均相对分子质量不再改变,平衡不移动,能说明达到平衡状态;D项,NO、CO、N2、CO2的浓度不再变化是各物质的浓度保持不变,能说明达到平衡状态;E项,单位时间内生成2n mol碳氧双键即生成n mol的CO2,反应向正反应方向,同时消耗n mol N≡N即消耗n mol N2,反应向逆反应方向,但不与物质计量数成正比,故不能说明达到平衡状态。答案为CD;
③根据图像知,改变某一外界条件,平衡向正反应方向移动,可增大反应物的浓度,也可增大压强。答案为增大反应物浓度 增大压强;
(3)阳极是失电子的一极为CO,CO失电子后成为CO2,在KOH电解质溶液中最终生成CO![]() ,电极反应式:CO-2e+4OH=CO
,电极反应式:CO-2e+4OH=CO![]() +2H2O。答案为CO-2e+4OH===CO32-+2H2O;
+2H2O。答案为CO-2e+4OH===CO32-+2H2O;
(4)A.降低温度,不能提高反应的速率,A项不符合题意;B.增大压强加入催化剂,可以加快化学反应速率,增大压强使平衡向着气体体积减小的方向移动,正向移动,NO的转化率增大,B项符合题意;C.升高温度可以加快反应速率,但是该反应为放热反应,会减小NO的转化率,加入N2,反应逆向移动,NO转化率降低,C项不符合题意;D.及时将产物移走,可以增加NO的转化率,但是不能增加反应速率。答案为B。


科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述正确的是
A. 反应物的总能量低于生成物的总能量时,该反应必须加热才能发生
B. 2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l) △H=-akJ·mol-1,则中和热为a/2kJ·mol-1
C. 2H2(g)+O2(g)=2H2O(l);△H1=-akJ·mol-1,则氢气燃烧热为akJ·mol-1
D. N2(g)+3H2(g)=2NH3(g);△H=-akJ·mol-1,则将14gN2(g)和足量H2置于一密闭容器中,充分反应后放出0.5akJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.从海水得到的粗食盐水中常含Ca2+、Mg2+、SO42-,需要分离提纯.现有含少量CaCl2、MgSO4的粗食盐水,在除去悬浮物和泥沙之后,要用4种试剂①盐酸、②Na2CO3、③NaOH、④BaCl2来除去食盐水中Ca2+、Mg2+、SO42-。提纯时的操作步骤和加入试剂的情况如图1。

图1中a、b、c、d分别表示上述4种试剂中的一种,试回答:
(1)沉淀A的名称是____。
(2)试剂d是____;判断试剂d已经足量的方法是____。
(3)加入b、c后溶液中发生的化学反应的化学方程式为____。
(4)现有图2所示仪器,过滤出沉淀A、B、C时必须用到的是___(填序号)。
Ⅱ.海带等藻类物质经过处理后,可以得到碘水,欲从碘水中提取碘,需要图2仪器中的____(填序号),该仪器名称为____,向该碘水中加入四氯化碳以提取碘单质的实验操作叫做____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列说法正确的是
① 18g D2O含有的电子数为10NA;
② 1mol Na2O2与水完全反应时转移电子数为2NA ;
③ 12g石墨烯(单层石墨)中含有六元环的个数为0.5NA;
④ 在标准状况下,22.4LSO3的物质的量为1mol;
⑤ 7.8g过氧化钠中含有的离子数为0.3NA;
⑥ 28g 硅晶体中含有2NA个Si—Si键
⑦ 200mL1mol/LFe2(SO4)3溶液中,Fe3+和SO42-离子数的总和是NA
⑧ 在常温常压下,0.1mol铁与0.1molCl2充分反应,转移的电子数为0.3NA
⑨ 标准状况下,22.4LNO和11.2LO2混合后气体的分子总数为1.5NA
⑩ S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA
A、①③⑤⑧ B、②④⑥⑦ C、③⑤⑥⑩ D、⑤⑧⑨⑩
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将CO2慢慢通入一定体积的NaOH溶液中,溶液的pH随CO2体积(标准状况下)的变化曲线如图所示,则下列说法中正确的是
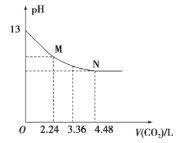
A. NaOH溶液的物质的量浓度为0.1 mol/L,体积为1 L
B. M、N点离子浓度的都是c(HCO3-)>c(CO32 -)
C. 曲线上任意点都符合:c(Na+)+c(H+)=c(CO32 -)+c(HCO3-)+c(OH-)
D. V=3.36 L时,溶液中的离子浓度关系是:c(Na+)>c(HCO3- )>c(CO32 -)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】决定物质性质的重要因素是物质结构。请回答下列问题:
(1)已知元素M是组成物质Ca5(PO4)3F的一种元素。元素M的气态原子逐个失去第1个至第5个电子所需能量(即电离能,用符号I1至I5表示)如表所示:
I1 | I2 | I3 | I4 | I5 | |
电离能 | 589.8 | 1145.4 | 4912.4 | 6491 | 8153 |
元素M化合态常见化合价是_________价,其基态原子电子排布式为_________。
(2)Ca3(PO4)3F中非金属元素电负性由大到小的顺序为_________。
(3)PO43-的中心原子的杂化方式为_________,该离子的空间构型为_________,键角为________,其等电子体有_________ (请写出两种)。
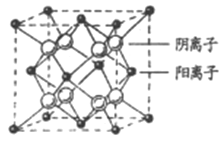
(4)CaF2晶胞结构如图所示,则CaF2晶体中与Ca2+最近且等距离的Ca2+数目为_________;已知Ca2+和F半径分别为a cm、b cm,阿伏加德罗常数为NA,M为摩尔质量,则晶体密度为________g·cm3(不必化简)。
(5)已知MgO与CaO的晶体结构相似,其摩氏硬度的大小关系为_________,原因为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍钴锰酸锂电池是一种高功率动力电池。下列流程采用废旧锂离子电池正极材料(正极一般以铝箔作为基底,两侧均匀涂覆正极材料,正极材料包括一定配比的正极活性物质,如钴酸锂、磷酸铁锂、锰酸锂和三元材料等)制备镍钴锰酸锂三元正极材料(![]() )
)![]() )
)
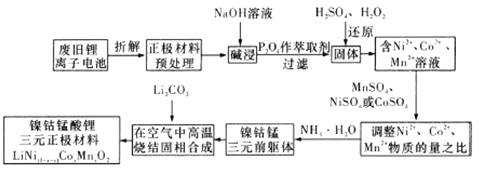
回答下列问题:
(1)写出正极碱浸过程中的离子方程式:________________;能够提高碱浸效率的方法有____________(至少写两种)。
(2)废旧锂离子电池拆解前进行“放电处理”有利于锂在正极的回收,其原因是_________________。
(3)![]() 中
中![]() 元素化合价为_______________,其参与“还原”反应的离子方程式为___________。
元素化合价为_______________,其参与“还原”反应的离子方程式为___________。
(4)溶液温度和浸渍时间对钴的浸出率影响如图所示:

则浸出过程的最佳条件是___________________。
(5)已知溶液中![]() 的浓度为
的浓度为![]() ,缓慢通入氨气,使其产生
,缓慢通入氨气,使其产生![]() 沉淀,列式计算
沉淀,列式计算![]() 沉淀完全时溶液的
沉淀完全时溶液的![]() ______________________(已知离子沉淀完全时
______________________(已知离子沉淀完全时![]() ,溶液体积变化忽略不计)
,溶液体积变化忽略不计)
(6)写出“高温烧结固相合成”过程的化学方程式:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可由乙苯生产苯乙烯:![]() ,下列有关说法正确的是
,下列有关说法正确的是
A. 乙苯和苯乙烯均能发生取代反应、加聚反应和氧化反应
B. 用溴水可以区分苯乙烯和乙苯
C. 1 mol苯乙烯最多可与4 mol氢气加成,加成产物的一氯代物共有5种
D. 乙苯和苯乙烯分子中共平面的碳原子数最多都为7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法中不正确的是
A. 14g由N2和13C2H2组成的混合物中,所含中子数为7NA
B. CH4与白磷(P4)都为正四面体结构,则1 mol CH4与1molP4所含共价键的数目均为4NA
C. 反应N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4kJ/mol,若放出热量4.62kJ,则转移电子的数目为0.3NA
2NH3(g) △H=-92.4kJ/mol,若放出热量4.62kJ,则转移电子的数目为0.3NA
D. 含0.5 mol NH4NO3与 r mol NH3·H2O的中性溶液中,含有NH4+的数目为0.5NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com