
| A、小苏打是弱电解质,其水溶液导电能力很弱 |
| B、氨气是非电解质,但氨水能导电 |
| C、稀释醋酸溶液,可以促进醋酸分子电离使溶液pH减小 |
| D、硫酸是强电解质,在水溶液和熔融状态下均能导电 |


科目:高中化学 来源: 题型:
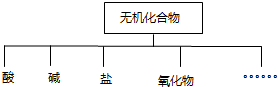
| 物质 类别 | 酸 | 碱 | 盐 | 氧化物 |
| 化学式 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、A元素在周期表中的位置是第六周期第ⅠA族 |
| B、单质A性质稳定 |
| C、A元素的最高价氧化物的水化物是一种强碱 |
| D、A有多种氧化物,但均不与水反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
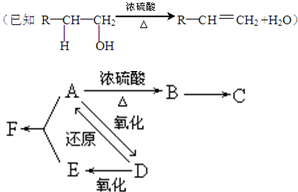
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、从HCl、HBr到HI的熔点沸点升高与范德华力大小有关 |
B、CO的一种等电子体为NO+,它的电子式为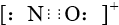 |
| C、H2O的熔点沸点大于H2S,是由于H2O分子之间存在氢键这种化学键 |
| D、电子层序数越大,s原子轨道的形状相同、半径越大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③⑤ | B、②③⑤ |
| C、②③ | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2SO4=2H++S6++4O2- |
| B、AlCl3=Al3++Cl3- |
| C、Ba(OH)2=Ba2++2OH- |
| D、Na2CO3=Na2++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com