
| 0.2mol |
| 0.4L |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
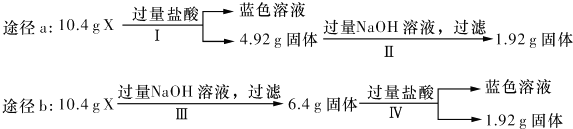
| A、由工可知X中一定存在Fe2 O3、Cu |
| B、无法判断混合物中是否含有Al2O3 |
| C、1.92 g固体成分为Cu |
| D、原混合物中m( Fe2O3):m(Cu)=1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、NO3-、I-、H2SO3 |
| B、Na+、Fe3+、NO3-、CO32- |
| C、Al3+、NO3-、SO32-、OH- |
| D、NH4+、Na+、SO42-、CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
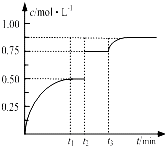 一定温度下,将1molM和1molN气体充入2L恒容密闭容器,发生反应M(g)+N(g)?xP(g)+Q(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体P的浓度随时间变化如图所示.下列说法正确的是( )
一定温度下,将1molM和1molN气体充入2L恒容密闭容器,发生反应M(g)+N(g)?xP(g)+Q(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体P的浓度随时间变化如图所示.下列说法正确的是( )| A、反应方程式中的x=1 |
| B、t2时刻改变的条件是使用催化剂 |
| C、t3时刻改变的条件是移去少量物质Q |
| D、t1~t3间该反应的平衡常数均为4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、③⑤ | B、③④ | C、②④ | D、①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、煤炭经气化、液化和干馏等过程,可以转化为清洁能 |
| B、利用二氧化碳制造全降解塑料,可以缓解温室效应 |
| C、利用生物方法脱除生活污水中的氮和磷,防止水体富营养化 |
| D、高纯硅广泛应用于太阳能电池、计算机芯片和光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:
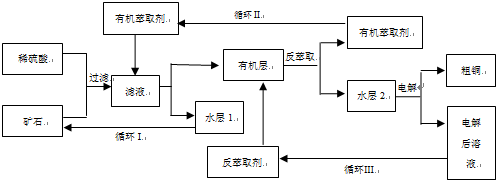
 三种基团,无环状结构,若A的相对分子质量为116,上述基团连接时碳原子跟碳原子相连,则A的结构简式是
三种基团,无环状结构,若A的相对分子质量为116,上述基团连接时碳原子跟碳原子相连,则A的结构简式是查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1molNH4+中含质子数为11NA |
| B、1molOH-中含电子数为10NA |
| C、1molNa+中含电子数为10NA |
| D、1molF-含有的质子数与电子数之和为10NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com