
| 1 |
| 100 |
| 1×10-14 |
| 1×10-11 |


科目:高中化学 来源: 题型:
| A、蛋白质在体内经消化后生成碳酸、硫酸、尿酸等,故它属于酸性食物 |
| B、葡萄吃起来是酸的,故它属于酸性食物 |
| C、食物的酸碱性与化学上所指溶液的酸碱性不同的 |
| D、正常情况下,人体血液的pH总保持弱碱性范围 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
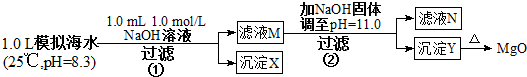
| 模拟海水中的离 子浓度(mol/L) | Na+ | Mg2+ | Ca2+ | Cl- | HCO3- |
| 0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②③④ | B、①⑥⑦ |
| C、①③⑤ | D、②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、m×50×18×6.02×1023 | ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
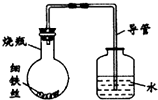 某研究性学习课题组为探究影响钢铁生锈的因素,设计了如下的方案:在A、B、C、D四只小烧瓶中分别放入干燥的细铁丝、浸过食盐水的细铁丝、浸过清水的细铁丝、食盐水及细铁丝,并使铁丝完全浸没在食盐水中,然后装配成如图所示的四套装置,每隔一段时间测量导管中水面上升的高度,结果如下表(表中所列数据为导管中水面上升的高度/cm)所示.
某研究性学习课题组为探究影响钢铁生锈的因素,设计了如下的方案:在A、B、C、D四只小烧瓶中分别放入干燥的细铁丝、浸过食盐水的细铁丝、浸过清水的细铁丝、食盐水及细铁丝,并使铁丝完全浸没在食盐水中,然后装配成如图所示的四套装置,每隔一段时间测量导管中水面上升的高度,结果如下表(表中所列数据为导管中水面上升的高度/cm)所示.| 时间/小时 | 0 | 0.5 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 |
| A瓶(盛干燥铁丝) | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| B瓶(盛沾了食盐水的铁丝) | 0 | 0.4 | 1.2 | 3.4 | 5.6 | 7.6 | 9.8 |
| C瓶(盛沾了清水的铁丝) | 0 | 0 | 0 | 0.3 | 0.8 | 2.0 | 3.5 |
| D瓶(盛完全浸没在食盐水中的铁丝) | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com