
【题目】聚合硫酸铁(简称PFS,化学式为[Fe(OH)n(SO4)3-n/2]m )是一种新型高效的无机高分子絮凝剂,广泛用于水的处理,现用一定质量的铁的氧化物(如下图)为原料来制取聚合硫酸铁。实验步骤如下: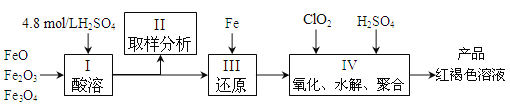
(1)实验室用18.4mol/L的浓硫酸配制250mL4.8mol/L的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和量筒外,还需的玻璃仪器__________。定容操作中若俯视容量瓶刻度线,所配硫酸溶液浓度将___________(填“偏高”、“偏低”或“无影响”)
(2)步骤Ⅱ取样分析溶液中的Fe2+、Fe3+的含量,目的是_______。
A.确定下一步还原所需铁的量 B.控制溶液中Fe2+与Fe3+含量比
C.确定氧化Fe2+所需ClO2的量 D.确保铁的氧化物酸溶完全
(3)写出步骤Ⅳ中用ClO2氧化Fe2+时的离子方程式:____________________。(还原产物为Cl-)
(4)为了分析产品聚合硫酸铁溶液中SO42-与Fe3+物质的量之比,有人设计了以下操作:
(I)取25mL聚合硫酸铁溶液,加入足量的BaCl2溶液,产生白色沉淀,白色沉淀经过过滤,洗涤、干燥后,称重,其质量为mg。
(II)另取25mL聚合硫酸铁溶液,加入足量铜粉,充分反应后过滤、洗涤,将滤液和洗液合并配成250mL溶液,取该溶液25.00mL与0.1000 mol/L V mL KMnO4酸性溶液恰好完全反应,MnO4-被还原为Mn2+。
回答下列问题:
① 根据(II)步骤中判断Cu2+、Fe2+、MnO4-、Fe3+氧化性由强到弱的顺序:__________。
② 聚合硫酸铁中SO42-与Fe3+的物质的量之比为____________(用含m、V的代数式表示)。
【答案】(1)250mL容量瓶、胶头滴管;偏高(2)AC
(3)5Fe2++ClO2+4H+=5Fe3++Cl-+2H2O
(4)①MnO4->Fe3+>Cu2+>Fe2+②(m/233):(V/200)
【解析】
试题分析:(1)实验室用18.4molL-1的浓硫酸配制250mL4.8molL-1的硫酸溶液,用量筒量取浓硫酸,在烧杯中溶解,并用玻璃棒搅拌,移入250mL容量瓶,最后需要用胶头滴管定容;定容操作中若俯视容量瓶刻度线,则容量瓶中溶液体积偏少,因此所配硫酸溶液浓度将偏高;
(2)由于控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原为Fe2+,所以确定下一步还原所需铁的量,然后Fe2+再被氧化Fe3+,需要确定氧化Fe2+所需ClO2的量,答案选AC。
(3)酸性条件下,ClO2将Fe2+氧化为Fe3+,ClO2被还原为Cl-,反应离子方程式为5Fe2++ClO2+4H+=5Fe3++Cl-+2H2O:
(4)①发生反应:Cu+2Fe3+=2Fe2++Cu2+,5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,氧化剂氧化性强于氧化产物氧化性,氧化性由强到弱的顺序为MnO4->Fe3+>Cu2+>Fe2+;
②mg白色沉淀为BaSO4,由硫酸根守恒n(SO42-)=n(BaSO4)=m/233=mol,由原子守恒与电电子转移守恒可得关系式:5Fe3+~5Fe2+~MnO4-,则n(Fe3+)=5n(MnO4-)=5×V×10-3L×0.1mol/L×250mL/25mL,n(SO42-):n(Fe3+)=m/233mol:5×V×10-3L×0.1mol/L×250mL/25mL=(m/233):(V/200)。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、X是中学化学中常见的物质,它们之间的转化关系加下图所示(部分产物已略去)。请回答下列问题:
![]()
(1)若A能使湿润的红色石蕊试纸变蓝,C为红棕色的气体。A转化为B的化学方程为 ,
请写出实验室制取A的化学方程式: 。
(2)若B是一种常见的温室气体,则B转化为C的化学方程式 。
(3)若X是金属单质,向B、C溶液中分别滴加AgNO3溶液,均产生不溶于稀硝酸的白色沉淀,则B的化学式为 。保存C溶液常加入少量X,其目的是 ,请写出B转化为C的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1molH2(g)和2molI2(g)置于某2L密闭容器中,在一定温度下发生反应:H2(g)+I2(g)![]() 2HI(g)△H<0,并达到平衡。HI的体积分数w(HI)随时间变化如下图(Ⅱ)所示,若改变反应条件,w(HI)的变化曲线如下图(Ⅰ)所示,则改变的条件可能是
2HI(g)△H<0,并达到平衡。HI的体积分数w(HI)随时间变化如下图(Ⅱ)所示,若改变反应条件,w(HI)的变化曲线如下图(Ⅰ)所示,则改变的条件可能是

A.恒温恒容条件下,加入适当催化剂
B.恒温条件下,缩小反应容器体积
C.恒容条件下,升高温度
D.恒温条件下,扩大反应容器体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种物质均易溶于水,分别按下列条件配成溶液,其中物质的量浓度最大的是
A.10mL5molL-1的A溶液加水配制成100mL溶液
B.9.2gB物质(式量为46)溶于水配成100mL溶液
C.1.806×1023个C的分子溶于水配成100mL溶液
D.0.1moLD物质溶于100mL2.5molL-1的D溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是宝贵的资源宝库,目前氯碱工业、海水提镁、海水提溴为人类提供了大量工业原料。下图是海水综合利用的部分流程图,据图回答问题:
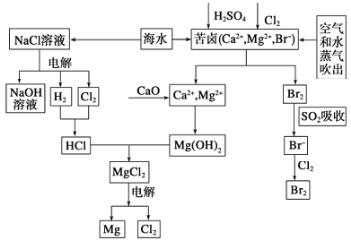
(1)由海水晒制的粗盐中含有Ca2+、Mg2+、SO42-等离子,为除去这些离子,所加试剂及其先后顺序为(写化学式) ___________________。
(2)①电解饱和食盐水的化学反应方程式为______________。
②制取MgCl2的过程中涉及反应:MgCl2·6H2O![]() MgCl2+6H2O,该反应要在HCl气氛中进行,原因是_______________。
MgCl2+6H2O,该反应要在HCl气氛中进行,原因是_______________。
(3)苦卤中通入Cl2置换出Br2,吹出后用SO2吸收,写出用SO2吸收发生的离子方程式_________,由此判断Cl2、Br2、SO2的氧化性由强到弱的顺序为__________________。
(4)也有工艺是在吹出Br2后用碳酸钠溶液吸收,形成溴化钠和溴酸钠,同时有CO2放出。该反应的离子方程式是_____________;最后再用H2SO4处理得到Br2,之后加入CCl4进行Br2的萃取,最终用_____________方法得到单质Br2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解下列溶液,一段时间后,再加入一定质量的另一种物质(括号内),溶液能与原来溶液完全一样的是:
A. NaCl(HCl) B.NaOH(NaOH);
C. CuCl2(CuO) D.CuSO4[Cu(OH)2]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾与铜绿是高中无机化学中较为复杂的物质,请根据要求回答以下各题:
(1)明矾与铜绿这两种物质中,属于纯净物的是 。
(2)明矾的化学式是 ,用于净水的用途是利用了胶体的 性质。
(3)铜绿的主要成分是碱式碳酸铜Cu2(OH)2CO3,其中Cu元素的化合价是 。已知金属铜长期暴露在空气中会与H2O、CO2、O2反应生成碱式碳酸铜,反应的化学方程式为:2Cu + O2 + H2O + CO2 = Cu2(OH)2CO3。当消耗1mol还原剂时,转移的电子数是 mol,请用双线桥法表示此反应电子转移的情况:2Cu + O2 + H2O + CO2 = Cu2(OH)2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A、B、C、D四种物质混合,发生如下反应:aA+bB![]() cC(s)+dD,当反应进行一段时间后,测得A减少了n mol,B减少了
cC(s)+dD,当反应进行一段时间后,测得A减少了n mol,B减少了![]() mol,C增加了
mol,C增加了![]() n mol,D增加了n mol。此时达到化学平衡状态。
n mol,D增加了n mol。此时达到化学平衡状态。
(1)该化学方程式中各物质的化学计量数:
a=________,b=________,c=________,d=________。
(2)若只改变压强,反应速率发生变化,但平衡不发生移动,该反应中各物质的聚集状态:A________,B____________,D___________。
(3)若只升高温度,反应一段时间后,测得四种物质其物质的量又达到相等,则该反应的正反应为________反应(填“放热”或“吸热”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com