
【题目】下列说法正确的是
A. 金刚石和石墨互为同素异构体,熔点和硬度都很高
B. 氕、氘、氚是氢元素的三种核素,质子数都为1
C. 乙醇和二甲醚(CH3—O—CH3)互为同系物
D. C4H10的一氯取代物只有一种
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案科目:高中化学 来源: 题型:
【题目】汉堡包的制作原料有鸡胸肉、面包、鸡蛋、生菜等。下列说法正确的是
A. 生菜中的纤维素经消化分解可被人体吸收
B. 面包中的淀粉进入口腔先被酶催化水解为麦芽糖
C. 鸡蛋中的化合物含量最少的是糖类,最多的是蛋白质
D. 鸡胸肉中含有的动物多糖一一糖原可被人体直接吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】V、W、X、Y、Z五种短周期元素的原子序数依次增大,在周期表中W与V、X相邻,Y与Z相邻,X、Y同主族,Z的单质可由其化合物发生反应制得,反应的离子方程式为
![]()
(1)上述反应中方框内的物质或离子为 (填化学式或离子符号)。
(2)Y、Z两种元素的简单离子的半径大小为 (用离子符号表示,半径用r表示)
(3)五种元素的最简单氢化物中,沸点最高的是 (填分子式),V、W、Y、Z四种元素的最高价含氧酸中有一种性质与其他三种不同,该酸的分子式为 。
(4)在催化剂作用下由VY2与Z2反应制得VZ4,该反应的化学方程式为VY2+Z2=VZ4+Y2Z2(未配平)。①写出上述反应的化学方程式: 。
②在Y2Z2分子中,Y与Z原子均满足8电子稳定结构,则Y2Z2的电子式为 。
(5)化合物ZnFe2Xa可作为新型纳米材料,常温下可将工业废气中的氧化物分解而除去。
![]()
若1mol ZnFe2Xa与YX2反应可生成0.75 mol Y,则a= ;1 mol ZnFe2Xa可分解物质的量之比为3:2的WX2、WX的混合气体的体积V= L(标准状况下)。
(6)Q与X同主族,位于第四周期,其原子序数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列三种化合物的化学组成中,含义相同的是
①所有核酸中的腺嘌呤核苷酸 ②DNA中的腺嘌呤核苷酸 ③RNA中的腺嘌呤核苷酸
A. ①和② B. ②和③
C. ①和③ D. 都不是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)下列生产、生活中的事例中没有发生氧化还原反应的是( )
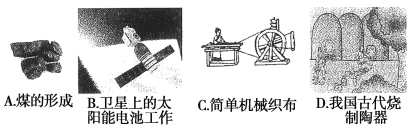
(2)水是人体的重要组成部分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原反应的关系”也可用下图表达。
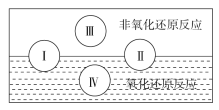
试写出有水参加的符合反应类型Ⅳ的一个离子反应方程式: ,其中水为________剂。
(3)氯化铵常用于焊接。如在焊接铜器时用过量的浓氯化铵溶液除去铜器表面的氧化铜以便焊接,其反应为:____CuO+____NH4Cl![]() ____Cu+____CuCl2+____N2↑+____H2O。
____Cu+____CuCl2+____N2↑+____H2O。
①配平此氧化还原反应方程式。(配平时系数为“1”必须写出)
②该反应中,被氧化的元素是________(填元素名称),氧化剂是____________(填化学式)。
③往反应后的热溶液中加入过量澄清的石灰水,发现有气泡产生和蓝色沉淀生成,写出两个相应现象的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水晒盐后所得的苦卤中含有较高浓度的MgCl2、KCl以及金属溴化物。以下是苦卤化学分离的过程。
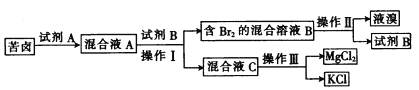
回答下列问题:
(1) 若试剂A是一种有色气体单质,则A是__________ (填化学式);写出该反应的离子方程式:___________。
(2) “操作II”是_______ (填“蒸发”“ 蒸馏”“ 分液”或“重结晶”,下同),“操作III”是________。
(3) 试剂B可能是下列物质中的________ (填字母)。
A.饱和NaCl溶液 B.CCl4 c.NaOH D.乙醇
实验室中也可用苯代替试剂B,但工业生产中,通常不使用苯,理由是____________________(任写两点)。
(4) MgCl2中可能含有NaCl杂质,检验杂质存在的方法是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体内的微量元素的含量甚微,但是对人体的健康起着重要作用。下列全部是微量元素的是
A. I、K、O、S B. Fe、Zn、Cu、B、Mo
C. N、H、O、P、C D. Fe、Ca、Cu、Mg、C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物是目前造成大气污染的主要气体。NO在空气中存在如下反应:
![]()
(1)上述反应分两步完成,其中第一步反应①如下,写出第二步反应②的热化学方程式(其反应的焓变
△H2用含△H、△H1的式子来表示):
①![]()
②________。
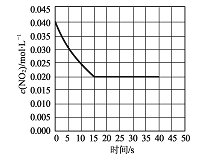
(2)在某温度下的一密闭容器中充人一定量的N02发生上述反应,测得NO2的浓度随时间的变化曲线如下图所示,前5秒内O2的平均生成速率为 mol.L-1.s-l,该条件下反应:2NO+O2![]() 2NO2的化学平衡常数数值为 ,平衡后某时刻,升高反应体系的温度,建立新平衡状态后,测的混合气体的平均相对分子质量小于原平衡状态,则:2NO(g)+O2 (g)
2NO2的化学平衡常数数值为 ,平衡后某时刻,升高反应体系的温度,建立新平衡状态后,测的混合气体的平均相对分子质量小于原平衡状态,则:2NO(g)+O2 (g)![]() 2NO2 (g)△H (填“>”或“<”)0。
2NO2 (g)△H (填“>”或“<”)0。
(3)2NO(g)+O2(g)![]() 2NO2 (g)的两步反应中,反应①的反应速率数值较大,是一个快反应,会快速建立平衡状态,而反应②是一个慢反应,则决定反应2NO(g)+O2 (g)
2NO2 (g)的两步反应中,反应①的反应速率数值较大,是一个快反应,会快速建立平衡状态,而反应②是一个慢反应,则决定反应2NO(g)+O2 (g)![]() 2NO2 (g)反应速率的是反应________(填“①”或“②”);对(2)中反应体系升高温度的过程中,发现2NO(g)+O2 (g)
2NO2 (g)反应速率的是反应________(填“①”或“②”);对(2)中反应体系升高温度的过程中,发现2NO(g)+O2 (g)![]() 2NO2 (g)的反应速率变慢,结合该反应的两步反应过程分析可能的原因: (反应未使用催化剂)。
2NO2 (g)的反应速率变慢,结合该反应的两步反应过程分析可能的原因: (反应未使用催化剂)。
(4)若(2)中反应体系,反应开始时使用催化剂,请在(2)的图中画出该反应体系反应进程可能的曲线。
(5)电解法处理氮氧化物是目前大气污染治理的一个新思路。其原理是将NO.在电解池中分解成无污染的N2和02除去,如图所示,,两电极间是固体氧化物电解质,在一定条件下可自由传导O2-。则电解池阴极的电极反应式为_____________
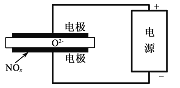
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com