
【题目】氮氧化物是目前造成大气污染的主要气体。NO在空气中存在如下反应:
![]()
(1)上述反应分两步完成,其中第一步反应①如下,写出第二步反应②的热化学方程式(其反应的焓变
△H2用含△H、△H1的式子来表示):
①![]()
②________。
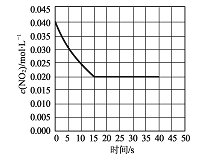
(2)在某温度下的一密闭容器中充人一定量的N02发生上述反应,测得NO2的浓度随时间的变化曲线如下图所示,前5秒内O2的平均生成速率为 mol.L-1.s-l,该条件下反应:2NO+O2![]() 2NO2的化学平衡常数数值为 ,平衡后某时刻,升高反应体系的温度,建立新平衡状态后,测的混合气体的平均相对分子质量小于原平衡状态,则:2NO(g)+O2 (g)
2NO2的化学平衡常数数值为 ,平衡后某时刻,升高反应体系的温度,建立新平衡状态后,测的混合气体的平均相对分子质量小于原平衡状态,则:2NO(g)+O2 (g)![]() 2NO2 (g)△H (填“>”或“<”)0。
2NO2 (g)△H (填“>”或“<”)0。
(3)2NO(g)+O2(g)![]() 2NO2 (g)的两步反应中,反应①的反应速率数值较大,是一个快反应,会快速建立平衡状态,而反应②是一个慢反应,则决定反应2NO(g)+O2 (g)
2NO2 (g)的两步反应中,反应①的反应速率数值较大,是一个快反应,会快速建立平衡状态,而反应②是一个慢反应,则决定反应2NO(g)+O2 (g)![]() 2NO2 (g)反应速率的是反应________(填“①”或“②”);对(2)中反应体系升高温度的过程中,发现2NO(g)+O2 (g)
2NO2 (g)反应速率的是反应________(填“①”或“②”);对(2)中反应体系升高温度的过程中,发现2NO(g)+O2 (g)![]() 2NO2 (g)的反应速率变慢,结合该反应的两步反应过程分析可能的原因: (反应未使用催化剂)。
2NO2 (g)的反应速率变慢,结合该反应的两步反应过程分析可能的原因: (反应未使用催化剂)。
(4)若(2)中反应体系,反应开始时使用催化剂,请在(2)的图中画出该反应体系反应进程可能的曲线。
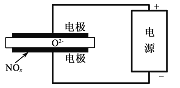
(5)电解法处理氮氧化物是目前大气污染治理的一个新思路。其原理是将NO.在电解池中分解成无污染的N2和02除去,如图所示,,两电极间是固体氧化物电解质,在一定条件下可自由传导O2-。则电解池阴极的电极反应式为_____________
【答案】(1)N2O2(g)+O2(g)=2NO2(g)△H2=△H-△H1;(2)0.001;100;<;(3)决定总反应速率的是反应②,温度升高后反应①向左移动,造成N2O2的浓度减小,温度升高对于反应②的影响弱于N2O2浓度减小的影响,导致反应②的速率变慢;
(4)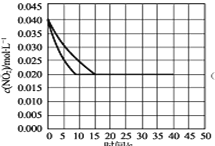 ;
;
(5)2NOx+4xe-=N2+2xO2-。
【解析】
试题分析:(1)总式减去①,得出N2O2(g)+O2(g)=2NO2(g)△H2=△H-△H1;(2)根据化学反应速率的定义,v(NO2)=(0.04-0.03)/5mol/(L·s)=0.002mol/(L·s),根据反应速率之比等于化学计量数之比,即v(O2)=v(NO2)/2=0.001mol/(L·s),2NO2(g)![]() 2NO(g)+O2(g),K=c2(NO)×c(O2)/c2(NO2)=0.022×0.01/0.022=0.01,2NO(g)+O2(g)
2NO(g)+O2(g),K=c2(NO)×c(O2)/c2(NO2)=0.022×0.01/0.022=0.01,2NO(g)+O2(g)![]() 2NO2(g),此时的平衡常数=1·K-1=100;升高温度,平均摩尔质量减少,说明平衡向逆反应方向进行,根据勒夏特列原理,正反应方向为放热反应,即△H<0;(3)根据信息,反应②是一个慢反应,决定反应速率是慢反应,即反应②温度升高后反应①向左移动,造成N2O2的浓度减小,温度升高对于反应②的影响弱于N2O2浓度减小的影响,导致反应②的速率变慢;(4)使用催化剂,加快反应速率,对化学平衡无影响,因此图像是:
2NO2(g),此时的平衡常数=1·K-1=100;升高温度,平均摩尔质量减少,说明平衡向逆反应方向进行,根据勒夏特列原理,正反应方向为放热反应,即△H<0;(3)根据信息,反应②是一个慢反应,决定反应速率是慢反应,即反应②温度升高后反应①向左移动,造成N2O2的浓度减小,温度升高对于反应②的影响弱于N2O2浓度减小的影响,导致反应②的速率变慢;(4)使用催化剂,加快反应速率,对化学平衡无影响,因此图像是:

(5)阴极上得到电子化合价降低,根据装置图,NOx在阴极上得电子,根据电解原理,阴离子向阳极移动,即阴极上产生O2-,因此阴极电极反应式为2NOx+4xe-=N2+2xO2-。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 金刚石和石墨互为同素异构体,熔点和硬度都很高
B. 氕、氘、氚是氢元素的三种核素,质子数都为1
C. 乙醇和二甲醚(CH3—O—CH3)互为同系物
D. C4H10的一氯取代物只有一种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组用海水晒盐后的高浓度卤水制取碱式碳酸镁的工艺流程如下:
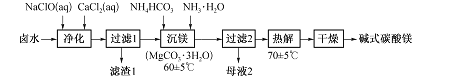
卤水(原料)的成分如下表:
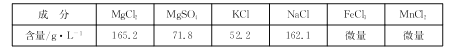
回答下列问题:
(1)“净化”时,加入CaCl2溶液的作用是 ,Mn2+转化为MnO(OH)2沉淀的离子方程式为____。
(2)过滤时用到的玻璃仪器有烧杯、 、 ;滤渣1中的成分有MnO(OH)2、 (填化学式)。
(3)“沉镁”反应的离子方程式为 ,母液2中可提取的一种氮肥是 (填化学式),提取的方法是 。
(4)准确称取7.640 g所得碱式碳酸镁溶于足量盐酸中,收集到l 344 mL(标准状况下)气体;往所得溶液中加入足量NaOH溶液,过滤、洗涤、灼烧至质量不再变化,称量得固体3.200 g。该碱式碳酸镁的化学式为 ,MgCO3.3H2O热解生成碱式碳酸镁的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列现象中,不是因为发生化学反应而产生的是( )
A.乙烯使酸性KMnO4溶液褪色
B.将苯滴入溴水中,振荡后水层接近无色
C.乙烯使溴的四氯化碳溶液褪色
D.甲烷与氯气混合,光照一段时间后黄绿色消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关硅及其化合物用途的说法中,不正确的是
A. 硅单质是制造光电池的主要原料 B. 二氧化硅是制造光导纤维的材料
C. 可用石英坩埚加热氢氧化钠固体 D. 玻璃、水泥、陶瓷都是硅酸盐产品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室里,用足量的浓盐酸与一定量的MnO2反应,来制取氯气。
⑴用“双线桥法”标出电子转移情况
MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
⑵若生成2.24L标准状况时的氯气,请计算(写出必要的计算过程):
①理论上需要多少克MnO2参加反应?
②被氧化的HCl的物质的量为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中只含有Na+、Al3+、Cl-、SO42-四种离子,已知前三种离子的个数比为3:2:1,则溶液中Al3+和SO42-的离子个数比为( )
A. 1:2 B. 1:4 C. 3:4 D. 3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、技术密不可分,下列有关说法错误的是
A. 天然气是高效清洁的化石燃料 B. 煤的干馏属于化学变化
C. 无污染的安全、优质,营养类食品属于“绿色食品” D. 我国使用最早的合金是生铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于食物的酸碱性,下列说法正确的是( )
A. 食物溶于水后的溶液中pH小于7,则为成酸性食物
B. 由碳、氮、硫、磷等元素组成的蛋白质是酸性食物
C. 蔬菜、水果多含钾、钠、钙、镁等盐类,习惯称为酸性食物
D. 柠檬酸是酸性食物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com