
【题目】关于食物的酸碱性,下列说法正确的是( )
A. 食物溶于水后的溶液中pH小于7,则为成酸性食物
B. 由碳、氮、硫、磷等元素组成的蛋白质是酸性食物
C. 蔬菜、水果多含钾、钠、钙、镁等盐类,习惯称为酸性食物
D. 柠檬酸是酸性食物
科目:高中化学 来源: 题型:
【题目】氮氧化物是目前造成大气污染的主要气体。NO在空气中存在如下反应:
![]()
(1)上述反应分两步完成,其中第一步反应①如下,写出第二步反应②的热化学方程式(其反应的焓变
△H2用含△H、△H1的式子来表示):
①![]()
②________。
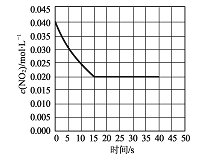
(2)在某温度下的一密闭容器中充人一定量的N02发生上述反应,测得NO2的浓度随时间的变化曲线如下图所示,前5秒内O2的平均生成速率为 mol.L-1.s-l,该条件下反应:2NO+O2![]() 2NO2的化学平衡常数数值为 ,平衡后某时刻,升高反应体系的温度,建立新平衡状态后,测的混合气体的平均相对分子质量小于原平衡状态,则:2NO(g)+O2 (g)
2NO2的化学平衡常数数值为 ,平衡后某时刻,升高反应体系的温度,建立新平衡状态后,测的混合气体的平均相对分子质量小于原平衡状态,则:2NO(g)+O2 (g)![]() 2NO2 (g)△H (填“>”或“<”)0。
2NO2 (g)△H (填“>”或“<”)0。
(3)2NO(g)+O2(g)![]() 2NO2 (g)的两步反应中,反应①的反应速率数值较大,是一个快反应,会快速建立平衡状态,而反应②是一个慢反应,则决定反应2NO(g)+O2 (g)
2NO2 (g)的两步反应中,反应①的反应速率数值较大,是一个快反应,会快速建立平衡状态,而反应②是一个慢反应,则决定反应2NO(g)+O2 (g)![]() 2NO2 (g)反应速率的是反应________(填“①”或“②”);对(2)中反应体系升高温度的过程中,发现2NO(g)+O2 (g)
2NO2 (g)反应速率的是反应________(填“①”或“②”);对(2)中反应体系升高温度的过程中,发现2NO(g)+O2 (g)![]() 2NO2 (g)的反应速率变慢,结合该反应的两步反应过程分析可能的原因: (反应未使用催化剂)。
2NO2 (g)的反应速率变慢,结合该反应的两步反应过程分析可能的原因: (反应未使用催化剂)。
(4)若(2)中反应体系,反应开始时使用催化剂,请在(2)的图中画出该反应体系反应进程可能的曲线。
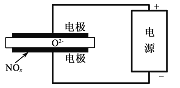
(5)电解法处理氮氧化物是目前大气污染治理的一个新思路。其原理是将NO.在电解池中分解成无污染的N2和02除去,如图所示,,两电极间是固体氧化物电解质,在一定条件下可自由传导O2-。则电解池阴极的电极反应式为_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据相似相溶规则和实际经验,下列叙述不正确的是 ( )
A. 白磷(P4)易溶于CS2,但难溶于水
B. NaCl易溶于水,难溶于CCl4
C. 碘易溶于苯,微溶于水
D. 卤化氢易溶于水,也易溶于CCl4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
方法I | 用碳粉在高温条件下还原CuO |
方法II | 用肼(N2H4)还原新制Cu(OH)2 |
方法III | 电解法,反应为2Cu+H2O |
(1)已知:2Cu(s)+![]() O2(g)=Cu2O(s)△H=﹣akJmol﹣1
O2(g)=Cu2O(s)△H=﹣akJmol﹣1
C(s)+![]() O2(g)=CO(g)△H=﹣bkJmol﹣1
O2(g)=CO(g)△H=﹣bkJmol﹣1
Cu(s)+![]() O2(g)=CuO(s)△H=﹣ckJmol﹣1
O2(g)=CuO(s)△H=﹣ckJmol﹣1
则方法I发生的反应:2Cu O(s)+C(s)=Cu2O(s)+CO(g);△H= kJmol﹣1.
(2)工业上很少用方法I制取Cu2O,是由于方法I反应条件不易控制,若控温不当,会降低Cu2O产率,请分析原因: .
(3)方法II为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2.
该制法的化学方程式为 .
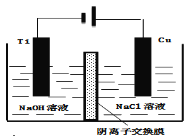
(4)方法III采用离子交换膜控制电解液中OH﹣的浓度而制备纳米Cu2O,装置如图所示,写出电极反应式
并说明该装置制备Cu2O的原理 .
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验:
2H2O(g)![]() 2H2(g)+O2(g)△H>0,水蒸气的浓度(mol/L)随时间t(min)
2H2(g)+O2(g)△H>0,水蒸气的浓度(mol/L)随时间t(min)
变化如下表所示.
序号 | Cu2O a克 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
① | 方法II | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
② | 方法III | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
③ | 方法III | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
下列叙述正确的是 (填字母代号).
a.实验的温度:T2<T1
b.实验①前20min的平均反应速率v(O2)=7×10﹣5molL﹣1min﹣1
c.实验②比实验①所用的Cu2O催化效率高
d. 实验①、②、③的化学平衡常数的关系:K1=K2<K3.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁发生吸氧腐蚀的时候,发生还原反应的电极方程式是
A. Fe-2e-==Fe2+
B. 2H++2e-==H2↑
C. 4OH--4e-==2H2O+O2↑
D. 2H2O+O2+4e-==4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[物质结构与性质]K4[Fe(CN)6]强热可发生反应:
3 K4[Fe(CN)6] ![]() 2 (CN)2↑+12 KCN +N2↑+ Fe3C + C
2 (CN)2↑+12 KCN +N2↑+ Fe3C + C
(1)K4[Fe(CN)6]中Fe2+的配位数为 (填数字);Fe2+基态外围电子排布式为 。
(2)(CN)2分子中碳原子杂化轨道类型为 ;1molK4[Fe(CN)6]分子中含有![]() 键的数目为 。
键的数目为 。
(3)O![]() 与CN
与CN![]() 互为等电子体,则O
互为等电子体,则O![]() 的电子式为 。
的电子式为 。
(4)Fe3C的晶胞结构中碳原子的配位数为6,碳原子与紧邻的铁原子组成的空间构型为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)主要用于棉纺、造纸业的漂白剂,也用于食品消毒、水处理等。
已知①亚氯酸钠(NaClO2)受热易分解。
②NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O。
③纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
以氯酸钠等为原料制备亚氯酸钠的工艺流程如下:
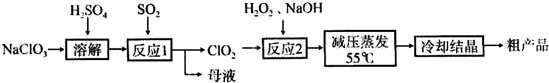
(1)“反应1”需要鼓入空气,空气的作用是_______________
(2)“反应2”的化学方程式为:_______________
(3)采取“减压蒸发”而不用“常压蒸发”,原因是_______________;结晶后需要对晶体洗涤,为了减少损失,可以用_______洗澡晶体。
(4)从“母液”中可回收的主要物质是___________;
(5)要得到纯的亚氯酸钠晶体(NaClO2·3H2O),对粗产品的必须进行的操作名称__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com