
【题目】纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
方法I | 用碳粉在高温条件下还原CuO |
方法II | 用肼(N2H4)还原新制Cu(OH)2 |
方法III | 电解法,反应为2Cu+H2O |
(1)已知:2Cu(s)+![]() O2(g)=Cu2O(s)△H=﹣akJmol﹣1
O2(g)=Cu2O(s)△H=﹣akJmol﹣1
C(s)+![]() O2(g)=CO(g)△H=﹣bkJmol﹣1
O2(g)=CO(g)△H=﹣bkJmol﹣1
Cu(s)+![]() O2(g)=CuO(s)△H=﹣ckJmol﹣1
O2(g)=CuO(s)△H=﹣ckJmol﹣1
则方法I发生的反应:2Cu O(s)+C(s)=Cu2O(s)+CO(g);△H= kJmol﹣1.
(2)工业上很少用方法I制取Cu2O,是由于方法I反应条件不易控制,若控温不当,会降低Cu2O产率,请分析原因: .
(3)方法II为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2.
该制法的化学方程式为 .
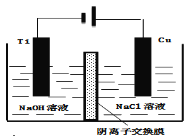
(4)方法III采用离子交换膜控制电解液中OH﹣的浓度而制备纳米Cu2O,装置如图所示,写出电极反应式
并说明该装置制备Cu2O的原理 .
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验:
2H2O(g)![]() 2H2(g)+O2(g)△H>0,水蒸气的浓度(mol/L)随时间t(min)
2H2(g)+O2(g)△H>0,水蒸气的浓度(mol/L)随时间t(min)
变化如下表所示.
序号 | Cu2O a克 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
① | 方法II | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
② | 方法III | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
③ | 方法III | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
下列叙述正确的是 (填字母代号).
a.实验的温度:T2<T1
b.实验①前20min的平均反应速率v(O2)=7×10﹣5molL﹣1min﹣1
c.实验②比实验①所用的Cu2O催化效率高
d. 实验①、②、③的化学平衡常数的关系:K1=K2<K3.
【答案】(1)2c﹣a﹣b;(2)若温度不当,会生成Cu;
(3)4Cu(OH)2+N2H4![]() 2Cu2O+6H2O+N2↑;
2Cu2O+6H2O+N2↑;
(4)阴极电极反应:2H++2e﹣=H2↑,c(OH﹣)增大,通过阴离子交换膜进入阳极室
阳极电极反应:2 Cu﹣2e﹣+2OH﹣=Cu2O+H2O,获得Cu2O;
(5)cd
【解析】
试题分析:(1)已知:①2Cu(s)+1/2O2(g)=Cu2O(s);△H=-akJmol-1,
②C(s)+1/2O2(g)=CO(g);△H=-bkJmol-1,
③Cu(s)+1/2O2(g)=CuO(s);△H=-ckJmol-1
由盖斯定律可知,①-③×2+②得2CuO(s)+C(s)=Cu2O(s)+CO(g);△H=2c-a-bkJmol-1;
(2)在加热条件下,C与CuO也能生成Cu,所以若温度不当,会生成Cu;
(3)液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,其反应的方程式为:4Cu(OH)2+N2H4![]() 2Cu2O+6H2O+N2↑;
2Cu2O+6H2O+N2↑;
(4)阴极上氢离子得电子生成氢气,阴极电极反应:2H++2e-=H2↑,c(OH-)增大,通过阴离子交换膜进入阳极室,阳极发生氧化反应,碱性条件下Cu在阳极失去电子得到Cu2O与H2O,阳极电极反应式为:2Cu-2e-+2OH-=Cu2O+H2O;
(5)a.实验温度越高达到化学平衡时水蒸气转化率越大,②和③相比,③转化率高,所以T2>T1,故a错误;b.实验①前20min的平均反应速率 v(H2)=![]() =
=![]() =7×10-5 molL-1 min-1,则v(O2)=1/2v(H2)=3.5×10-5mol/(L.min),故b错误;c.②③化学平衡状态未改变,反应速率加快,则是加入了催化剂,催化剂的活性越高,速率越快,在相等时间内,③中水蒸气的浓度变化比②快,则实验②比实验①所用的Cu2O催化效率高,故c正确;d.该反应为吸热反应,温度越高,k越大,由a分析可知,T2>T1,所以实验①、②、③的化学平衡常数的关系:K1=K2<K3,故d正确;故答案为cd。
=7×10-5 molL-1 min-1,则v(O2)=1/2v(H2)=3.5×10-5mol/(L.min),故b错误;c.②③化学平衡状态未改变,反应速率加快,则是加入了催化剂,催化剂的活性越高,速率越快,在相等时间内,③中水蒸气的浓度变化比②快,则实验②比实验①所用的Cu2O催化效率高,故c正确;d.该反应为吸热反应,温度越高,k越大,由a分析可知,T2>T1,所以实验①、②、③的化学平衡常数的关系:K1=K2<K3,故d正确;故答案为cd。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列有关硅及其化合物用途的说法中,不正确的是
A. 硅单质是制造光电池的主要原料 B. 二氧化硅是制造光导纤维的材料
C. 可用石英坩埚加热氢氧化钠固体 D. 玻璃、水泥、陶瓷都是硅酸盐产品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】华盛顿大学的研究团队采用新型的太阳能热过程生产水泥,可实现C02零排放。当电解低于800℃ 时,碳酸钙先分解成为CaO和CO2,电解质为熔融的碳酸钠,基本原理如图所示,下列说法不正确的是( )
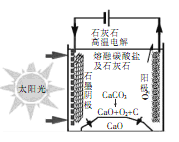
A.生产过程中能量转化方式是光能、电能转化为化学能
B.石墨电极的电极反应式为3CO2 +4e- =C+ 2CO32-
C.电解过程中熔融碳酸钠的物质的量不发生变化
D.电解过程中若产生11.2 LO2,则转移2 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D为四种可溶性的盐,它们的阳离子分别可能是Ba2+、Ag+、Na+、Cu2+中的某一种,阴离子分别可能是NO![]() 、SO
、SO![]() 、Cl-、CO
、Cl-、CO![]() 中的一种。
中的一种。
①若把四种盐分别溶于盛有蒸馏水的四支试管中,只有C盐的溶液呈蓝色;
②若向①的四支试管中分别加入盐酸,B盐的溶液有沉淀生成,D盐的溶液有无色无味的气体逸出。
根据①②实验事实可推断它们的化学式为:
(1)A________,B________,C________,D________。
(2)写出C与Ba(OH)2溶液反应的离子方程式:_____________________。
(3)C溶液中阴离子的检验方法:_________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列不属于有机物种类繁多的原因是( )
A. 同分异构现象
B. 碳原子的结合方式种类多
C. 多个碳原子结合时碳链长
D. 碳原子的空间排队列方式多样
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于食物的酸碱性,下列说法正确的是( )
A. 食物溶于水后的溶液中pH小于7,则为成酸性食物
B. 由碳、氮、硫、磷等元素组成的蛋白质是酸性食物
C. 蔬菜、水果多含钾、钠、钙、镁等盐类,习惯称为酸性食物
D. 柠檬酸是酸性食物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知—C4H9有4种同分异构体,不必写出C4H10O的结构简式,试说明其作为醇的同分异构体的数目( )
A. 2种 B. 4种 C. 3种 D. 5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关铁的氧化物的说法中,不正确的是( )
A.赤铁矿主要成分是Fe2O3,Fe2O3是红棕色的,常用作红色油漆和涂料
B.Fe3O4是黑色晶体,其中1/3的铁显+2价,2/3的铁显+3价
C.FeO、Fe2O3都不溶于水,但都能和盐酸反应生成相应的盐
D.FeO不稳定,在空气中加热迅速被氧化成Fe2O3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com