
【题目】某溶液中只含有Na+、Al3+、Cl-、SO42-四种离子,已知前三种离子的个数比为3:2:1,则溶液中Al3+和SO42-的离子个数比为( )
A. 1:2 B. 1:4 C. 3:4 D. 3:2
科目:高中化学 来源: 题型:
【题目】海水晒盐后所得的苦卤中含有较高浓度的MgCl2、KCl以及金属溴化物。以下是苦卤化学分离的过程。
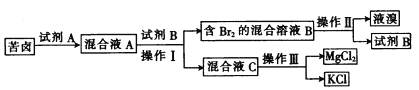
回答下列问题:
(1) 若试剂A是一种有色气体单质,则A是__________ (填化学式);写出该反应的离子方程式:___________。
(2) “操作II”是_______ (填“蒸发”“ 蒸馏”“ 分液”或“重结晶”,下同),“操作III”是________。
(3) 试剂B可能是下列物质中的________ (填字母)。
A.饱和NaCl溶液 B.CCl4 c.NaOH D.乙醇
实验室中也可用苯代替试剂B,但工业生产中,通常不使用苯,理由是____________________(任写两点)。
(4) MgCl2中可能含有NaCl杂质,检验杂质存在的方法是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物是目前造成大气污染的主要气体。NO在空气中存在如下反应:
![]()
(1)上述反应分两步完成,其中第一步反应①如下,写出第二步反应②的热化学方程式(其反应的焓变
△H2用含△H、△H1的式子来表示):
①![]()
②________。
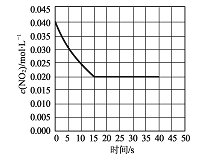
(2)在某温度下的一密闭容器中充人一定量的N02发生上述反应,测得NO2的浓度随时间的变化曲线如下图所示,前5秒内O2的平均生成速率为 mol.L-1.s-l,该条件下反应:2NO+O2![]() 2NO2的化学平衡常数数值为 ,平衡后某时刻,升高反应体系的温度,建立新平衡状态后,测的混合气体的平均相对分子质量小于原平衡状态,则:2NO(g)+O2 (g)
2NO2的化学平衡常数数值为 ,平衡后某时刻,升高反应体系的温度,建立新平衡状态后,测的混合气体的平均相对分子质量小于原平衡状态,则:2NO(g)+O2 (g)![]() 2NO2 (g)△H (填“>”或“<”)0。
2NO2 (g)△H (填“>”或“<”)0。
(3)2NO(g)+O2(g)![]() 2NO2 (g)的两步反应中,反应①的反应速率数值较大,是一个快反应,会快速建立平衡状态,而反应②是一个慢反应,则决定反应2NO(g)+O2 (g)
2NO2 (g)的两步反应中,反应①的反应速率数值较大,是一个快反应,会快速建立平衡状态,而反应②是一个慢反应,则决定反应2NO(g)+O2 (g)![]() 2NO2 (g)反应速率的是反应________(填“①”或“②”);对(2)中反应体系升高温度的过程中,发现2NO(g)+O2 (g)
2NO2 (g)反应速率的是反应________(填“①”或“②”);对(2)中反应体系升高温度的过程中,发现2NO(g)+O2 (g)![]() 2NO2 (g)的反应速率变慢,结合该反应的两步反应过程分析可能的原因: (反应未使用催化剂)。
2NO2 (g)的反应速率变慢,结合该反应的两步反应过程分析可能的原因: (反应未使用催化剂)。
(4)若(2)中反应体系,反应开始时使用催化剂,请在(2)的图中画出该反应体系反应进程可能的曲线。
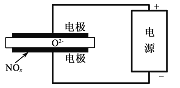
(5)电解法处理氮氧化物是目前大气污染治理的一个新思路。其原理是将NO.在电解池中分解成无污染的N2和02除去,如图所示,,两电极间是固体氧化物电解质,在一定条件下可自由传导O2-。则电解池阴极的电极反应式为_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于基本营养物质的说法正确的是
A.所有蛋白质均可通过颜色反应来鉴别
B.葡萄糖和蔗糖不是同分异构体,但属于同系物
C.糖类、油脂、蛋白质都只由C、H、O三种元素组成的
D.油脂在酸性条件下水解为丙三醇和高级脂肪酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关性质的比较,不能用元素周期律解释的是
A. 碱性:KOH>NaOH B. 金属性:Na>Mg
C. 稳定性:HF>CH4 D. 酸性:HF<HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知I-、Fe3+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性的顺序为:
SO2>I->Fe2+>H2O2>Cl-,则下列反应不可能发生的是( )
A.2Fe3++SO2+2H2O===2Fe2++SO![]() +4H+
+4H+
B.I2+SO2+2H2O===H2SO4+2HI
C.2Fe2++I2===2Fe3++2I-
D.H2O2+SO2===H2SO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com