
����Ŀ��ij����С���ú�ˮɹ�κ�ĸ�Ũ��±ˮ��ȡ��ʽ̼��þ�Ĺ����������£�
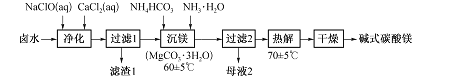
±ˮ��ԭ�����ijɷ����±���
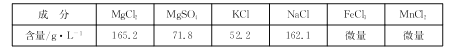
�ش��������⣺
��1����������ʱ������CaCl2��Һ�������� ��Mn2+ת��ΪMnO��OH��2���������ӷ���ʽΪ____��
��2������ʱ�õ��IJ����������ձ��� �� ������1�еijɷ���MnO��OH��2�� ���ѧʽ����
��3������þ����Ӧ�����ӷ���ʽΪ ��ĸҺ2�п���ȡ��һ�ֵ����� ���ѧʽ������ȡ�ķ����� ��
��4��ȷ��ȡ7��640 g���ü�ʽ̼��þ�������������У��ռ���l 344 mL����״���������壻��������Һ�м�������NaOH��Һ�����ˡ�ϴ�ӡ��������������ٱ仯�������ù���3��200 g���ü�ʽ̼��þ�Ļ�ѧʽΪ ��MgCO3��3H2O�Ƚ����ɼ�ʽ̼��þ�Ļ�ѧ����ʽΪ ��
���𰸡���1����ȥ±ˮ�е�SO42����Mn2����ClO����2OH��=MnO��OH��2��Cl������2��©������������Fe��OH��3��CuSO4����3��Mg2����HCO3����NH3��H2O��H2O=MgCO3��3H2O����NH4����NH4Cl�������ᾧ����4��3MgCO3��Mg��OH��2��4H2O��4[MgCO3��3H2O]![]() 3MgCO3��Mg��OH��2��4H2O��7H2O��CO2����
3MgCO3��Mg��OH��2��4H2O��7H2O��CO2����
��������
�����������1�������к���SO42���������Ǿ�������˼���CaCl2������������CaSO4����ȥ±ˮ���е�SO42��������ClO����ǿ�����ԣ���Mn2�������ɣ�3��Mn����������ԭ��Cl�������ݻ��ϼ�������������ƽ�������ӷ�Ӧ����ʽMn2����ClO����2OH��=MnO��OH��2��Cl������2������ʹ�õ�������©�����ձ���������������Ȧ������̨����ֽ�ȣ���������ͼһ��±ˮ�ijɷ֣�����1�е�������Mn��OH��2��Fe��OH��3����3����������ͼ����þ�м���������NH4HCO3��NH3��H2O����������MgCO3��3H2O��������ӷ�Ӧ����ʽΪ��Mg2����HCO3����NH3��H2O��H2O=MgCO3��3H2O��NH4�����������ӷ�Ӧ����ʽ���õ�������NH4Cl�����������ᾧ�ķ�������4���õ���������CO2��n��CO32����=n��CO2��=1344��10��3/22��4mol=6��10��2mol�����õ�������MgO����n��Mg2����=n��MgO��=3��2/40mol=8��10��2mol�����ݵ���غ㣬��n��OH����=2n��Mg2������2n��CO32����=4��10��2mol���ᾧˮ�����ʵ���Ϊ��7��64��6��10��2��60��8��10��2��24��4��10��2��17��/=18mol=8��10��2mol����˻�ѧʽΪ3MgCO3��Mg��OH��2��4H2O���ֽ�ķ�Ӧ����ʽΪ4[MgCO3��3H2O]![]() 3MgCO3��Mg��OH��2��4H2O��7H2O��CO2����
3MgCO3��Mg��OH��2��4H2O��7H2O��CO2����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��V��W��X��Y��Z���ֶ�����Ԫ�ص�ԭ�������������������ڱ���W��V��X���ڣ�Y��Z���ڣ�X��Yͬ���壬Z�ĵ��ʿ����仯�������Ӧ�Ƶã���Ӧ�����ӷ���ʽΪ
![]()
��1��������Ӧ�з����ڵ����ʻ�����Ϊ ���ѧʽ�����ӷ��ţ���
��2��Y��Z����Ԫ�صļ����ӵİ뾶��СΪ �������ӷ��ű�ʾ���뾶��r��ʾ��
��3������Ԫ�ص�����⻯���У��е���ߵ��� �������ʽ����V��W��Y��Z����Ԫ�ص���ۺ���������һ���������������ֲ�ͬ������ķ���ʽΪ ��
��4���ڴ�����������VY2��Z2��Ӧ�Ƶ�VZ4���÷�Ӧ�Ļ�ѧ����ʽΪVY2+Z2��VZ4+Y2Z2��δ��ƽ������д��������Ӧ�Ļ�ѧ����ʽ�� ��
����Y2Z2�����У�Y��Zԭ�Ӿ�����8�����ȶ��ṹ����Y2Z2�ĵ���ʽΪ ��
��5��������ZnFe2Xa����Ϊ�������ײ��ϣ������¿ɽ���ҵ�����е�������ֽ����ȥ��
![]()
��1mol ZnFe2Xa��YX2��Ӧ������0��75 mol Y����a= ��1 mol ZnFe2Xa�ɷֽ����ʵ���֮��Ϊ3��2��WX2��WX�Ļ����������V= L����״���£���
��6��Q��Xͬ���壬λ�ڵ������ڣ���ԭ������Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮɹ�κ����õĿ�±�к��нϸ�Ũ�ȵ�MgCl2��KCl�Լ������廯������ǿ�±��ѧ����Ĺ��̡�
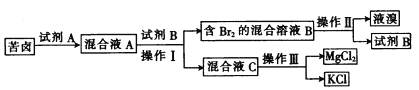
�ش��������⣺
(1) ���Լ�A��һ����ɫ���嵥�ʣ���A��__________ (�ѧʽ)��д���÷�Ӧ�����ӷ���ʽ:___________��
(2) ������II����_______ (������������ �������� ��Һ�������ؽᾧ������ͬ)��������III����________��
(3) �Լ�B���������������е�________ (����ĸ)��
A������NaCl��Һ B��CCl4 c��NaOH D���Ҵ�
ʵ������Ҳ���ñ������Լ�B������ҵ�����У�ͨ����ʹ�ñ���������____________________(��д����)��
(4) MgCl2�п��ܺ���NaCl���ʣ��������ʴ��ڵķ�����_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ڵ���Ԫ�صĺ����������Ƕ�����Ľ���������Ҫ���á�����ȫ������Ԫ�ص���
A. I��K��O��S B. Fe��Zn��Cu��B��Mo
C. N��H��O��P��C D. Fe��Ca��Cu��Mg��C
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����³�ѹ�£��ڴ�����ͬ�����������ݻ���ȵļס�����������ֱ���ж��������Ϳ������ֱַ������������ʵ�飺��N2O4![]() 2NO2 ��H �� 0��
2NO2 ��H �� 0��

��a�������������ڷ�ˮ�м���
��b���ڻ����϶���2 kg������
������������£����������������С�ıȽϣ���ȷ����
A����a���ף��ң���b���ף��� B����a���ף��ң���b���ף���
C����a���ף��ң���b���ף��� D����a���ף��ң���b���ף���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������̼����ȼ�ϵ���е�Ӧ��������Li2CO3��K2CO3Ϊ����ʣ���Ȼ�����������������ṩ��Ӧ����ȼ�ϵ��ʾ��ͼ���ң�

(1)���·�������������� ���� (����ĸA ��B)��
(2)������������Ӧ�����ӷ���ʽ�� ��
(3)�Դ�ȼ�ϵ��Ϊ��Դ��⾫��ͭ������·��0.6 mol e ת�ƣ��� g ��ͭ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ŀǰ��ɴ�����Ⱦ����Ҫ���塣NO�ڿ����д������·�Ӧ��
![]()
��1��������Ӧ��������ɣ����е�һ����Ӧ�����£�д���ڶ�����Ӧ�����Ȼ�ѧ����ʽ���䷴Ӧ���ʱ�
��H2�ú���H����H1��ʽ������ʾ����
��![]()
��________��
��2����ij�¶��µ�һ�ܱ������г���һ������N02����������Ӧ�����NO2��Ũ����ʱ��ı仯��������ͼ��ʾ��ǰ5����O2��ƽ����������Ϊ mol��L-1��s-l���������·�Ӧ��2NO+O2![]() 2NO2�Ļ�ѧƽ�ⳣ����ֵΪ ��ƽ���ijʱ�̣����߷�Ӧ��ϵ���¶ȣ�������ƽ��״̬��Ļ�������ƽ����Է�������С��ԭƽ��״̬����2NO��g��+O2 ��g��
2NO2�Ļ�ѧƽ�ⳣ����ֵΪ ��ƽ���ijʱ�̣����߷�Ӧ��ϵ���¶ȣ�������ƽ��״̬��Ļ�������ƽ����Է�������С��ԭƽ��״̬����2NO��g��+O2 ��g��![]() 2NO2 ��g����H ������>������<����0��
2NO2 ��g����H ������>������<����0��
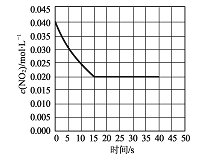
��3��2NO��g��+O2��g��![]() 2NO2 ��g����������Ӧ�У���Ӧ���ķ�Ӧ������ֵ�ϴ���һ���췴Ӧ������ٽ���ƽ��״̬������Ӧ����һ������Ӧ���������Ӧ2NO��g��+O2 ��g��
2NO2 ��g����������Ӧ�У���Ӧ���ķ�Ӧ������ֵ�ϴ���һ���췴Ӧ������ٽ���ƽ��״̬������Ӧ����һ������Ӧ���������Ӧ2NO��g��+O2 ��g��![]() 2NO2 ��g����Ӧ���ʵ��Ƿ�Ӧ________�������١������ڡ���������2���з�Ӧ��ϵ�����¶ȵĹ����У�����2NO��g��+O2 ��g��
2NO2 ��g����Ӧ���ʵ��Ƿ�Ӧ________�������١������ڡ���������2���з�Ӧ��ϵ�����¶ȵĹ����У�����2NO��g��+O2 ��g��![]() 2NO2 ��g���ķ�Ӧ���ʱ�������ϸ÷�Ӧ��������Ӧ���̷������ܵ�ԭ�� ����Ӧδʹ�ô�������
2NO2 ��g���ķ�Ӧ���ʱ�������ϸ÷�Ӧ��������Ӧ���̷������ܵ�ԭ�� ����Ӧδʹ�ô�������
��4������2���з�Ӧ��ϵ����Ӧ��ʼʱʹ�ô�����������2����ͼ�л����÷�Ӧ��ϵ��Ӧ���̿��ܵ����ߡ�
��5����ⷨ��������������Ŀǰ������Ⱦ������һ����˼·����ԭ���ǽ�NO���ڵ����зֽ������Ⱦ��N2��02��ȥ����ͼ��ʾ�������缫���ǹ������������ʣ���һ�������¿����ɴ���O2-������������ĵ缫��ӦʽΪ_____________
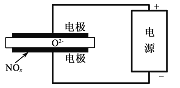
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ԫ�������ڱ��е�λ���жϣ�����Ԫ����ԭ�Ӱ뾶��С����
A. ��
B. ��
C. ̼
D. ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com